
Die chronisch-entzündliche Systemerkrankung Psoriasis ist eine schwere Bürde für betroffene Patienten und Patientinnen. Ein Meilenstein in der Therapie war die Einführung des monoklonalen Antikörpers Ustekinumab, der allerdings mit sehr hohen Kosten verbunden war. Inzwischen gibt es hierzu kostengünstigere Biosimilars.
Mit einer Prävalenz von durchschnittlich 2,5 % in der europäischen Bevölkerung zählt die Psoriasis zu den wichtigen Volkskrankheiten unserer Zeit. Die Definition als genetisch determinierte, chronisch-entzündliche Systemkrankheit mit überwiegender Beteiligung der Haut und der Gelenke und relevanten internistischen und psychiatrischen Komorbiditäten macht die interdisziplinäre Problematik dieses Krankheitsbildes klar.
Die manifeste Psoriasis beeinflusst alle Bereiche der Lebensqualität der Patientinnen und Patienten mit negativer Auswirkung auf das physische, psychische, soziale und sexuelle Wohlbefinden. Die unbehandelte Psoriasis kann zu einer Reduktion der Lebenserwartung führen.
Die modernen Biologika sind die effektivsten Medikamente zur erfolgreichen und nebenwirkungsarmen Behandlung der Psoriasis bis zur Symptomfreiheit. Die aktuelle S3-Leitlinie von 2025 [1] untermauert die klare Indikation für eine systemische antipsoriatische Therapie bei moderater und schwerer Psoriasis.
Nach wie vor sind die hohen Preise insbesondere der Orginalpräparate Grund für die selbst in der niedergelassenen Dermatologie oft zurückhaltenden Verschreibung. Dies gibt Anlass, die Bedeutung der günstigeren Biosimilars zu erörtern, denen noch immer mit einer gewissen Skepsis begegnet wird.

Biosimilars
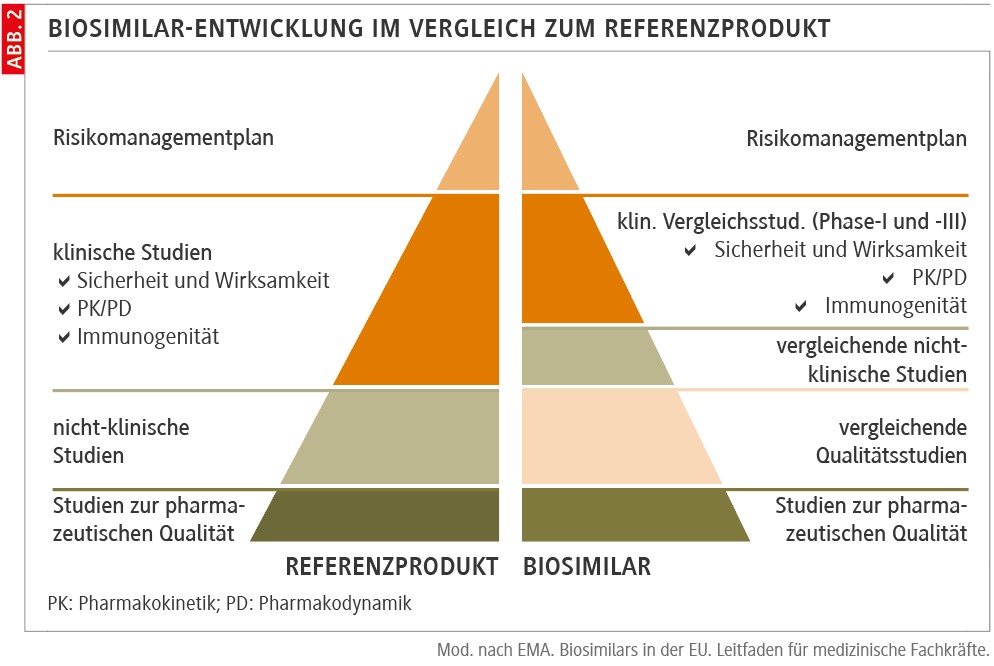
Per definitionem sind Biosimilars biologische Arzneimittel, die einem bereits zugelassenen Referenzarzneimittel sehr ähnlich sind. Während der Wirkstoff eines Generikums identisch mit dem des Originalpräparats ist, ist ein Biosimilar nur ähnlich zum Original. Das liegt an der unvermeidlichen Mikroheterogenität dieser komplexen Wirkstoffe. Die zusätzlichen Studien zu Wirksamkeit und Sicherheit machen die Entwicklung eines Biosimilars deutlich aufwendiger (Abb. 1 und 2) [2].
Als Biosimilars werden biologische Arzneimittel bezeichnet, die einem bereits zugelassenen Referenzarzneimittel sehr ähnlich sind.
Dennoch weisen sie keine klinisch bedeutsamen Unterschiede in Bezug auf Wirksamkeit, Sicherheit und Qualität auf. Ihre Markteinführung erfolgt frühestens nach dem Auslaufen des Patentschutzes des Originals. Ein wesentlicher Vorteil ist die Kostensenkung, einerseits durch den günstigeren Preis, andererseits auch durch den Einfluss auf den Wettbewerb.
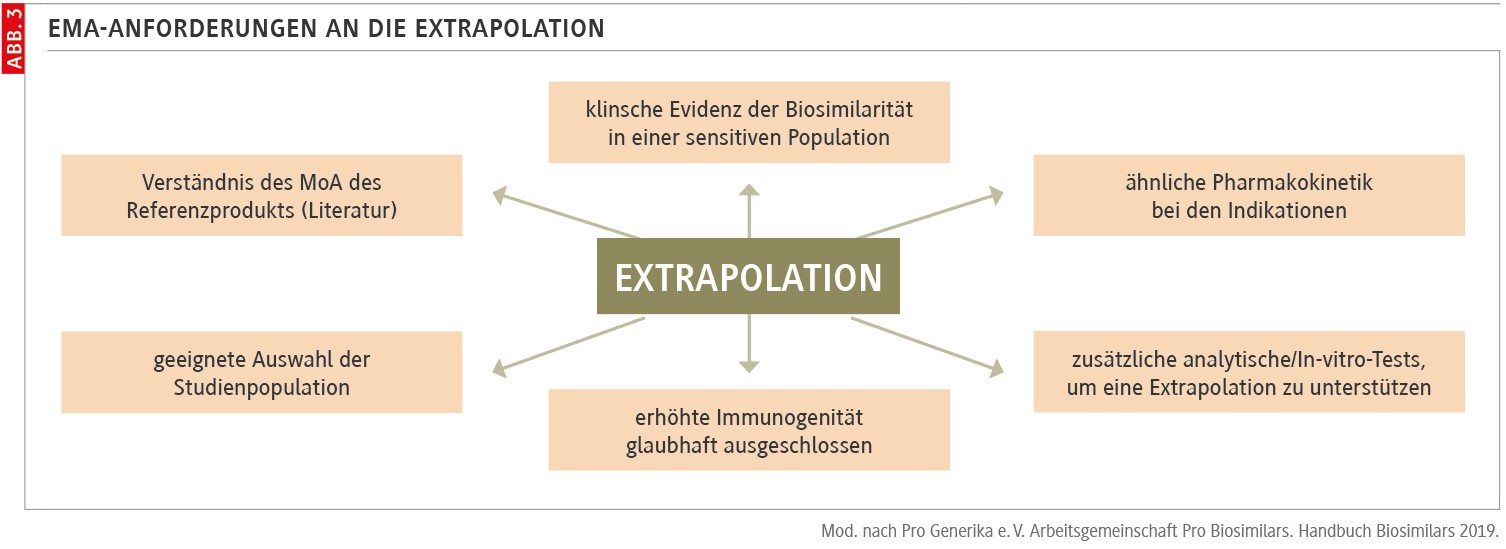
Weist ein Biosimilar gegenüber einem Referenzarzneimittel eine vergleichbare Sicherheit und Wirksamkeit bei einer therapeutischen Indikation auf, können die Sicherheits- und Wirksamkeitsdaten ggf. auf andere zugelassene Indikationen des Referenzarzneimittels extrapoliert werden [3].
Die Extrapolation ist ein wissenschaftlich begründeter Prozess zur Qualitätssicherung biologischer Referenzarzneimittel bei Produktionsänderungen, der auch auf Biosimilars angewendet wird (Abb. 3). Die Extrapolation der Daten auf andere Indikationen muss aber immer durch umfangreiche wissenschaftliche Evidenz gestützt werden [3,4]. Die Anforderungen an die Evidenz als Voraussetzung für die Extrapolation wurden von der EMA klar definiert [4].
Die teilweise noch vorhandenen Bedenken gegen die Biosimilars basieren hauptsächlich auf der Tatsache, dass es sich um Nachahmung komplexer chemischer Moleküle handelt – also keine exakten chemischen Kopien, sondern nur ähnliche (similar) Wirkstoffe. Der Nachweis von Wirkung und Sicherheit geschieht nicht durch erneute Grundlagenforschung oder entsprechende Frühphasestudien, sondern wird oft anhand von Surrogatkriterien vorausgesetzt und in der Anwendungsbeobachtung zementiert.
Die Real-World-Daten sind hier ganz wesentlich für die sachliche Beurteilung. Ein zentraler Diskussions- bzw. Streitpunkt ist die von den Generika bekannte und von den Kostenträgern gewünschte automatische Umstellung. Die oftmals sehr guten Erfahrungen und erfolgreichen Langzeitbehandlungen mit den Originalia und auch ein gewisses Loyalitätsempfinden können die Einwände von Ärzten und Ärztinnen sowie Patientenverbänden begründen. Auch GKV-Rabattverträge und Biosimilarquoten wirken hier wenig vertrauensbildend. Dabei ist der Zulassungsprozess für Biosimilars sehr komplex, denn es muss nachgewiesen sein, dass das Biosimilar in keiner klinisch relevanten Weise vom Original abweicht. Es kann ein Vorteil für die Bewertung der Biosimilars sein, dass es sich bei den nachgeahmten Originalen um bewährte Medikamente mit Langzeiterfahrung handelt.
Am Switch führt kein Weg vorbei
Die Gleichwertigkeit von Biosimilars für Betroffene, die zum ersten Mal ein Biologikum verordnet bekommen, gilt mittlerweile als unstrittig [5]. Verunsicherung besteht jedoch bezüglich der Austauschbarkeit des Referenzarzneimittels mit einem Biosimilar oder von Biosimilars untereinander (Switch): Ärztinnen und Ärzte waren deswegen sehr zurückhaltend bei der Umstellung von Patientinnen und Patienten auf ein Biosimilar, die unter Umständen über Jahre erfolgreich mit dem Referenzarzneimittel behandelt worden waren [3,6].
In der Zwischenzeit konnten viele Studien und Metaanalysen auch für die immunmodulatorisch wirksamen Antikörper zeigen, dass der Switch von einem Referenzarzneimittel auf ein Biosimilar weder die Wirksamkeit noch die Sicherheit der Therapie negativ beeinflusst [2,5,7-10]. Die Rahmenvorgaben der KVen und des GKV-Spitzenverbands benennen zur Kostendämpfung daher Verordnungsmindestquoten. Voraussetzung für einen Aut-idem-Austausch ist die Feststellung der Austauschbarkeit durch den G-BA. Das verordnete Biologikum muss zudem über eine Zulassung für die Indikation verfügen, für die es eingesetzt werden soll [11].
Ustekinumab
Als Ustekinumab 2009 zugelassen wurde, war dies ein Meilenstein in der Behandlung der Psoriasis. Das Präparat unterschied sich von den bis dahin verfügbaren TNF-α-Präparaten Adalimumab und Etanercept durch eine sehr viel höhere Effizienz und bessere Verträglichkeit. Insbesondere gab es bei diesem Wirkstoff nicht das Problem der Tachyphylaxie, d. h. den Wirkverlust durch Anti-TNF-α-Antikörper. Ustekinumab ist ein humaner monoklonaler Antikörper vom Typ IgG1k, der an die p40-Untereinheit von Interleukin(IL)-12 und IL-23 bindet und deren Bindung an seinen Zielrezeptor IL23R verhindert. In der Folge sind Differenzierung und Überproliferation zu T-Helferzellen (TH1- und TH17-Zellen) deutlich reduziert.
Ustekinumab überzeugte durch kontinuierliche, sichere und verträgliche Langzeitwirkung mit nahezu Erscheinungsfreiheit in den meisten Fällen und einem praktikablen Therapieintervall. Außerdem erlangte die Substanz die Zulassung auch für Erkrankte mit Psoriasis-Arthritis. Bis heute zählt Ustekinumab zu den am häufigsten verordneten Biologika. Allerdings führt das Originalprodukt bis heute die Preisliste deutlich an.
Seit Februar 2025 ist ein neues Ustekinumab-Biosimilar auf dem Markt, welches eine deutlich günstigere Therapiealternative bei nach bisherigen Ergebnissen dem Original gleichwertiger Wirkung, Sicherheit und Verträglichkeit aufweist. Die Zulassung gilt der Behandlung von Erwachsenen und Kindern ab 6 Jahren mit Plaque-Psoriasis sowie von Erwachsenen mit Psoriasis-Arthritis oder Morbus Crohn. Klinische Studiendaten belegen für das Biosimilar eine vergleichbare Sicherheit und Wirksamkeit wie beim Referenzprodukt.

Biologika sind aus der Therapie der Psoriasis heute nicht mehr wegzudenken. Ihr hoher Preis hat allerdings dazu geführt, das nicht alle infrage kommenden Patientinnen und Patienten auch damit versorgt wurden. Diese Lücke helfen Biosimilars zu schließen. Bei vergleichbarer Wirksamkeit und Sicherheit sind die Preise in der Regel deutlich günstiger.

Der Autor

Dr. med. Viktor Alexander Czaika
Facharzt für Dermatologie,
Venerologie und Innere Medizin
12439 Berlin
Bildnachweis: privat