
Das fortgeschrittene Ovarialkarzinom stellt weiterhin eine der größten Herausforderungen im Bereich der Gynäkologischen Onkologie dar. Mit dem Folatrezeptor-alpha steht jetzt ein neues, vielversprechendes Target für die Therapie zur Verfügung. Dieser Beitrag fasst die Studienergebnisse zusammen.
Das fortgeschrittene Ovarialkarzinom zählt zu den aggressivsten malignen Tumorerkrankungen des weiblichen Genitaltrakts und ist trotz vergleichsweise geringer Inzidenz eine der häufigsten Ursachen für tumorassoziierte Mortalität bei Frauen. Weltweit werden jährlich etwa 313 000 neue Fälle diagnostiziert, mit einer Inzidenzrate von rund 6,6 pro 100 000 Frauen. In Deutschland liegt die Inzidenz bei etwa 7–9 Neuerkrankungen pro 100 000 Frauen pro Jahr, mit rund 7 300 Neuerkrankungen jährlich (Stand: Robert Koch-Institut, 2022).
Besonders alarmierend ist die hohe Letalität: Das Ovarialkarzinom verursacht etwa 4 500 Todesfälle pro Jahr in Deutschland und ist damit nach dem Mammakarzinom die zweithäufigste Todesursache durch gynäkologische Malignome (krebsdaten.rki). Die 5-Jahres-Überlebensrate liegt über alle Stadien hinweg bei unter 45 %; insbesondere bedingt durch den häufig späten Diagnosezeitpunkt im fortgeschrittenen Stadium (FIGO III–IV), in dem über 70 % der Fälle entdeckt werden.
Standardtherapie
Die Standardtherapie beim primären Ovarialkarzinom ist nach einer kompletten zytoreduktiven Operation in der Primärsituation oder nach neoadjuvanter Therapie eine platinhaltige Chemotherapie in Kombination mit einem Taxan. In der Erhaltungstherapie wird abhängig vom HRD-Status eine PARP-Inhibitor-Therapie ggf. in Kombination mit dem Angiogenesehemmer Bevacizumab eingesetzt.

Bis zu 80–85 % der Patientinnen mit einem Ovarialkarzinom im fortgeschrittenen Stadium (FIGO III–IV) erleiden selbst nach kompletter Tumorresektion und platinbasierter Chemotherapie innerhalb von 2 bis 3 Jahren nach Abschluss der Primärtherapie ein Rezidiv. Auch in der Rezidivsituation ist eine Re-Induktionstherapie mit einer platinhaltigen Chemotherapie unter Hinzunahme von ggf. erneut Paclitaxel, Gemcitabin, pegyliertem liposomalem Doxorubicin oder Topotecan der Goldstandard. Etwa 40 % der Patientinnen entwickeln im Verlauf eine Platinresistenz bzw. platinrefraktäre Situation. In dieser Situation lagen bisher nur die bereits genannten Mono-Chemotherapeutika mit einer begrenzten Wirksamkeit zur Verfügung.
ADC gegen den Folatrezeptor-alpha
Bei Patientinnen mit dieser ungünstigen Prognose wurde als mögliches Target der Folatrezeptor-alpha (FRα) entdeckt. Dieser wird bei platinresistenten Ovarialkarzinompatientinnen in ca. 40 % überexprimiert. Hierbei handelt es sich um ein Protein, welches an der Zellmembran gebunden ist und Folsäure (Vitamin B9) von der Zellmembran in das Zellplasma transportiert.
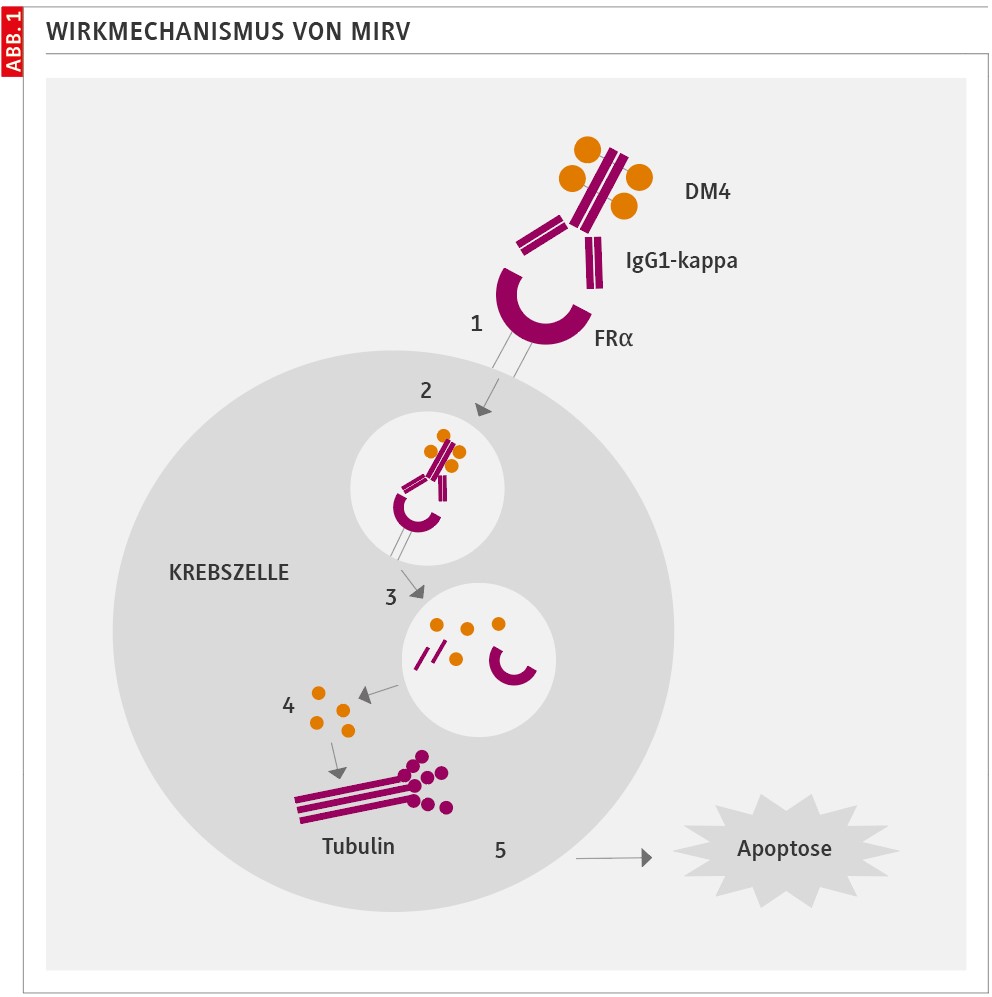
Die Wirkstoffklassen der Antibody-Drug-Konjugate (ADC) ermöglichen in dieser Lage eine zielgerichtete Therapieoption. Der monoklonale Antikörper Mirvetuximab-Soravtansin erkennt spezifisch FRα auf Tumorzellen. DM4, ein hochwirksames Mikrotubuli-Hemmstoff-Derivat, ist über einen Linker mit dem Antikörper verbunden und im Zellinneren abspaltbar (Abb. 1).
Neben der Zytotoxizität für die betroffene Zelle gibt es noch den sog. Bystander-Effekt: Die abgespaltene Substanz kann aus der Zielzelle herausdiffundieren und in benachbarte Zellen eindringen, auch wenn diese wenig oder kein FRα exprimieren. Dadurch wird auch in diesen Nachbarzellen die Mikrotubuli-Funktion gestört, was zum Zelltod führt.
Studienlage
Bereits in der einarmigen Phase-II-Studie SORAYA wurde 2023 die vielversprechende Therapie mittels Mirvetuximab-Soravtansin (MIRV) unter Beweis gestellt. SORAYA war eine klinische Studie mit 106 Patientinnen mit FRα-positiven Tumoren, darunter hochgradig seröses epitheliales Ovarialkarzinom (OC), Tubenkarzinom oder primäres Peritonealkarzinom. Zur Diagnose FRα-positiver Tumoren wurde der Ventana FOLR-2.1-Test verwendet. Hierbei handelt es sich um einen qualitativen immunhistochemischen Test, der eine mäßige bis starke membranständige Färbung in mindestens 75 % der Tumorzellen nachweist. Die an der Studie teilnehmenden Patientinnen wiesen einen ECOG-Performance-Status von 0 bis 1 auf, hatten sich mindestens 4 Wochen vor der ersten Dosis MIRV einem größeren chirurgischen Eingriff unterzogen und 1 bis 3 vorangegangene Krebstherapien erhalten, darunter eine Therapie mit Bevacizumab.
Die Behandlung erfolgte mit 6 mg/kg MIRV, das alle 3 Wochen intravenös verabreicht wurde. In der Studie erreichten 5 Patientinnen eine komplette Remission (CR), mit einer medianen Ansprechdauer von 6,9 Monaten (95%-KI 5,6–9,7) und einer Gesamtansprechrate (ORR) von 31,7 % (95%-KI 22,9–41,6 %).
Neben der Zytotoxizität für die betroffene Zelle gibt es noch den Bystander-Effekt auf Nachbarzellen.
Die häufigsten Nebenwirkungen waren verschwommenes Sehen, Übelkeit und Keratopathie. Zu den schwerwiegenderen Nebenwirkungen von MIRV gehörten okuläre Toxizität, Pneumonitis, periphere Neuropathie und fetale Toxizität. Die meisten Nebenwirkungen waren jedoch gut verträgliche gastrointestinale Symptome und Elektrolytstörungen.
Diese Studie stellte eine bahnbrechende zielgerichtete Therapie für das Ovarialkarzinom basierend auf FRα dar und setzte einen neuen Behandlungsstandard. Die Phase-III-Studie MIRASOL, die auf der ASCO-Konferenz 2023 vorgestellt wurde, bestätigte die Ergebnisse der SORAYA-Studie (Abb. 2).
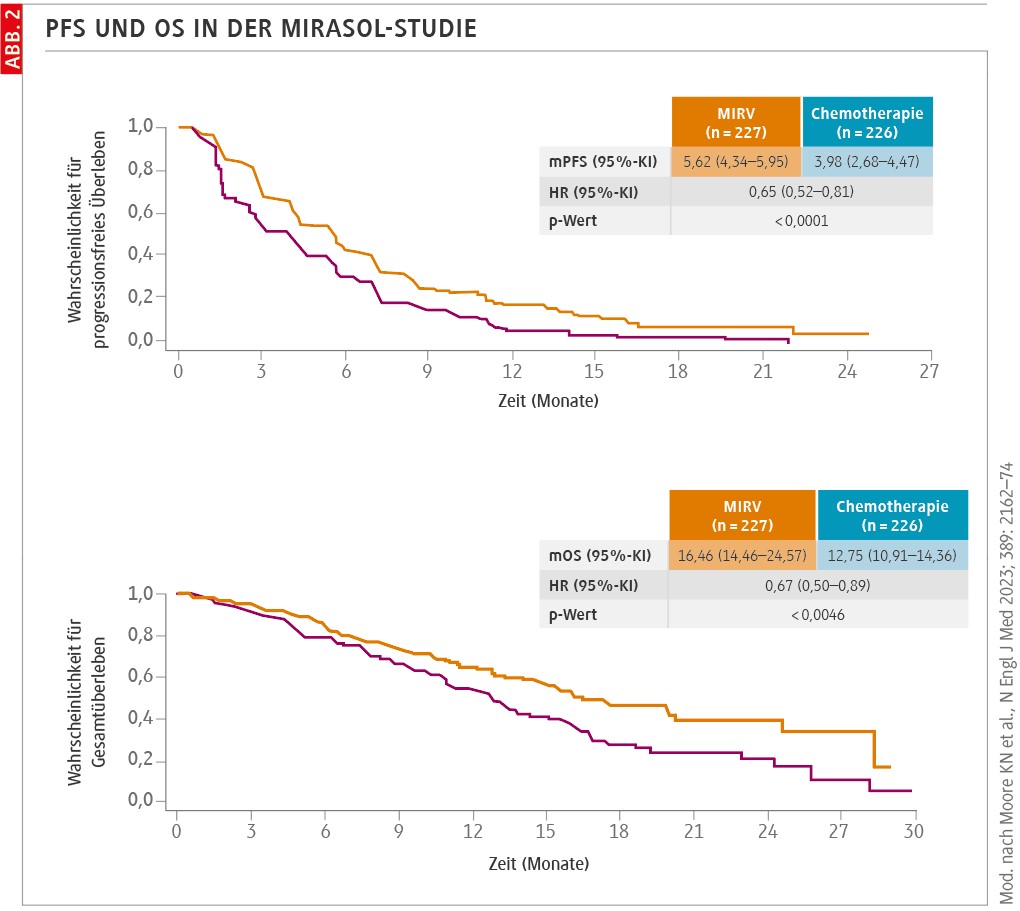
In dieser Studie wurden 453 Patientinnen mit Ovarialkarzinom (OC) und hoher FRα-Expression sowie 1 bis 3 vorangegangenen Therapien eingeschlossen. Sie wurden randomisiert und erhielten entweder Mirvetuximab-Soravtansin oder eine individuell gewählte Chemotherapie (Investegators Choice: IC) mit Paclitaxel, pegyliertem liposomalem Doxorubicin oder Topotecan. Die mediane Nachbeobachtungszeit betrug 13,1 Monate.
In der Bevacizumab-vorbehandelten Gruppe lag das progressionsfreie Überleben (PFS) vs. Standardtherapie bei einer Hazard Ratio (HR) von 0,64 (95%-KI 0,492–0,842) und das Gesamtüberleben (OS) bei HR 0,74 (95%-KI 0,535–1,036). In der Bevacizumab-naiven Gruppe lagen das PFS HR bei 0,66 (95%-KI 0,459–0,942) und das OS HR bei 0,51 (95%-KI 0,306–0,860). Das PFS unter MIRV betrug 5,62 Monate, verglichen mit 3,98 Monaten in der IC-Gruppe. 12 Patientinnen erreichten eine komplette Remission (CR), die Gesamtansprechrate (ORR) lag bei 42,3 %. Die Nebenwirkungen von MIRV entsprachen denen in der SORAYA-Studie: vorwiegend milde gastrointestinale Symptome und geringere Raten schwerwiegender Nebenwirkungen (Grad 3 oder höher) im Vergleich zur IC-Gruppe.
Aktuell ist Mirvetuximab-Soravtansin als Monotherapie zur Behandlung von erwachsenen Patientinnen mit Folatrezeptor-alpha-positivem, platinresistentem, high-grade serösem epithelialem Ovarial-, Tuben- oder primärem Peritonealkarzinom, die zuvor 1 bis 3 systemische Behandlungslinien erhalten haben, indiziert.
Weitere spannende Studienergebnisse und ggf. Zulassungserweiterungen werden aus den folgenden Studien erwartet:

Seit Längerem sehen wir erstmals einen Fortschritt in der medikamentösen Therapie des prognostisch ungünstigen rezidivierten, platinrefraktären Ovarialkarzinoms. Die Ergebnisse der SORAYA- und MIRASOL-Studien belegen Wirksamkeit und Sicherheit von Mirvetuximab-Soravtansin bei FRα-positivem Ovarialkarzinom und markieren einen entscheidenden Fortschritt in der personalisierten Therapie – mit dem Potenzial, das Behandlungskonzept für diese Patientinnengruppe nachhaltig zu verändern.

Die Autorin

Dr. med. Carina Zumdick
Klinik für Gynäkologie und
Gynäkologische Onkologie
Helios Dr. Horst Schmidt Kliniken
Wiesbaden
carina.zumdick@helios-gesundheit.de
Literatur bei der Autorin
Bildnachweis: privat