
Der Großteil aller Endometriumkarzinome wird in einem frühen Stadium entdeckt und die Patientinnen können in 75–90 % geheilt werden. Eine Herausforderung stellt jedoch weiterhin das fortgeschrittene oder rezidivierte Endometriumkarzinom dar. Dieser Beitrag gibt einen Überblick zur Immuntherapie.
Beim fortgeschrittenen oder rezidivierten Endometriumkarzinom ist in vielen Fällen eine prognostisch ungünstige oder palliative Situation gegeben und eine Systemtherapie erforderlich. Bisheriger Standard war eine Kombinationschemotherapie bestehend aus Carboplatin und Paclitaxel.
In den vergangenen Jahren ist es in der Therapie des Endometriumkarzinoms zu einem Paradigmenwechsel gekommen, da Stadien und Therapieoptionen mittlerweile in entscheidendem Maße durch das molekularpathologische Profil der Tumorerkrankung definiert werden. Neben p53, POLE und L1CAM spielt insbesondere das Kriterium einer Mismatch-repair-Defizienz bzw. einer Mikrosatelliteninstabilität hier eine wichtige Rolle. Unterschieden wird dabei eine am Tumorgewebe nachgewiesene Mismatch-repair-Defizienz bzw. Mikrosatelliteninstabilität (dMMR /MSI-H) von einem Mismatch-repair-profizienten Befund (pMMR / MSS).
Insbesondere für Patientinnen, die einen dMMR / MSI-H-Befund aufwiesen, konnte in klinischen und präklinischen Vorarbeiten ein Synergismus mit Immuntherapien gefunden werden.
Vor diesem Hintergrund wurden in den vergangenen Jahren mehrere große klinische Studien durchgeführt, die sich mit Kombinationsstrategien zwischen der bisherigen Standardchemotherapie und immuntherapeutischen Ansätzen für die Behandlung des fortgeschrittenen oder rezidivierten Endometriumkarzinoms auseinandersetzten. Die wichtigsten 3 Studien, deren Ergebnisse Einzug in die klinische Praxis gefunden haben und die zu relevanten Zulassungen bzw. Zulassungserweiterungen geführt haben, werden hier noch einmal kurz zusammengefasst.
NRG-GY018-Trial
In dieser 2023 im New England Journal of Medicine publizierten Studie [1] wurde der Einsatz des PD-L1-Inhibitors Pembrolizumab bei Patientinnen mit fortgeschrittenem Endometriumkarzinom untersucht. Insgesamt wurden 816 Patientinnen mit entweder einem primär fortgeschrittenen Endometriumkarzinom im Stadium FIGO III oder IVA und messbarer Tumorläsion oder einem primären Stadium IVB oder einem rezidivierten Endometriumkarzinom im Zuge der Studie behandelt.
Es erfolgte eine Randomisierung im Verhältnis 1 : 1. Die Studienteilnehmerinnen erhielten jeweils 6 Zyklen einer Chemotherapie mit Carboplatin AUC 5 und Paclitaxel 175 mg/m² q3w, entweder in Kombination mit Pembrolizumab 200 mg i. v. q3w oder einem Placebo.
Im Anschluss an die Chemotherapie wurde eine Erhaltungstherapie über 14 Zyklen fortgeführt, jeweils ebenfalls entweder mittels Pembrolizumab 200 mg i. v. q3w oder Placebo, dabei molekularpathologisch stratifiziert hinsichtlich eines dMMR- oder pMMR-Befundes.
In einer 12-Monats-Analyse zeigte sich, dass das progressionsfreie Überleben (PFS) in der dMMR-Kohorte bei 74 % in der Pembrolizumab-Gruppe lag gegenüber 38 % in der Placebo-Gruppe (HR 0,30; 95%-Konfidenzintervall (KI) 0,19 – 0,48); p < 0,001). Dieser Unterschied entsprach einem 70%igen Unterschied im relativen Risiko.
In der pMMR-Kohorte lag das mediane progressionsfreie Überleben bei 13,1 Monaten bei den Patientinnen, die mit Pembrolizumab behandelt wurden, gegenüber 8,7 Monaten in der Placebo-Gruppe (HR 0,54; 95%-KI 0,41– 0,71; p < 0,001). Die berichteten Toxizitäten lagen innerhalb des Profils, das von einer Hinzunahme von Pembrolizumab hatte erwartet werden können. Vor dem Hintergrund dieser positiven Ergebnisse wurde in der Folge die Zulassung für Pembrolizumab erweitert. Aktuell kann dieses auch für die Therapie des primär fortgeschrittenen oder rezidivierten Endometriumkarzinoms in Kombination mit einer Chemotherapie aus Carboplatin und Paclitaxel eingesetzt werden.
RUBY-Trial
Im selben Jahr wurde mit dem RUBY-Trial eine weitere große multizentrische, prospektiv-randomisierte Studie zur Immuntherapie des primär fortgeschrittenen Endometriumkarzinoms veröffentlicht [2]. In diesem Konzept kam der PD-1-Inhibitor Dostarlimab zum Einsatz. Insgesamt 494 Patientinnen mit entweder primär fortgeschrittenem Endometriumkarzinom im Stadium FIGO III oder IV oder erstmalig rezidiviertem Endometriumkarzinom wurden hier eingebracht.
Die Studienteilnehmerinnen wurden dabei in einem 1:1-Verhältnis randomisiert und erhielten entweder eine Behandlung mit 500 mg Dostarlimab i. v. oder Placebo, jeweils begleitend zu einer Standardchemotherapie mit Carboplatin AUC 5 und Paclitaxel 175 mg/m² q3w.
Die Behandlungsdauer betrug 6 Zyklen. Daran schloss sich eine Erhaltungstherapie an, bei der entweder Dostarlimab in einer Dosierung von 1 000 mg/m² i. v. oder ein Placebo gegeben wurden, jeweils alle 6 Wochen über einen gesamten Zeitraum von 3 Jahren. 23,9 % der Studienpatientinnen wiesen molekularpathologisch einen dMMR- bzw. MSI-H-Befund auf.
Nach 24 Monaten lag das geschätzte progressionsfreie Überleben in dieser Kohorte bei 61,4 % (95%-KI 46,3–73,4 %) bei denjenigen Patientinnen, die
Dostarlimab erhalten hatten vs. 15,7 % (95%-KI 7,2–27,0 %) bei den Patientinnen im Placeboarm (HR für Progression oder Tod 0,28; 95%-KI 0,16–0,50; p < 0,001).
Auch für die Gesamtpopulation ergab sich nach 24 Monaten ein relevanter PFS-Unterschied von 36,1 % in der Dostarlimab-Gruppe vs. 18,1 % in der Placebo-Gruppe (HR 0,64; 95%-KI 0,51–0,80; p < 0,001).
Für das Gesamtüberleben ergab sich nach 24 Monaten ein Anteil von 71,3 % (95%-KI 64,5–77,1 %) bei den Patientinnen, die Dostarlimab erhalten hatten, und 56,0 % (95%-KI 48,9–62,5) in der Placebo-Gruppe (HR 0,64; 95%-KI 0,46 – 0,87). Die häufigsten Nebenwirkungen waren Übelkeit (53,9 % in der Dostarlimab-Gruppe vs. 45,9 % in der Placebo-Gruppe), Alopezie (53,5 % vs. 50 %) und Fatigue (51,9 % vs. 54,5 %).
Insbesondere die sehr guten Ergebnisse für die Subgruppe der Patientinnen mit Mismatch-repair-defizientem Tumortyp (dMMR/MSI-H) führten zu einer Zulassungserweiterung. Dostarlimab ist aktuell somit auch zugelassen für die Behandlung von Patientinnen mit primär fortgeschrittenem oder rezidiviertem Endometriumkarzinom, begleitend zu einer Chemotherapie bestehend aus Carboplatin und Paclitaxel.
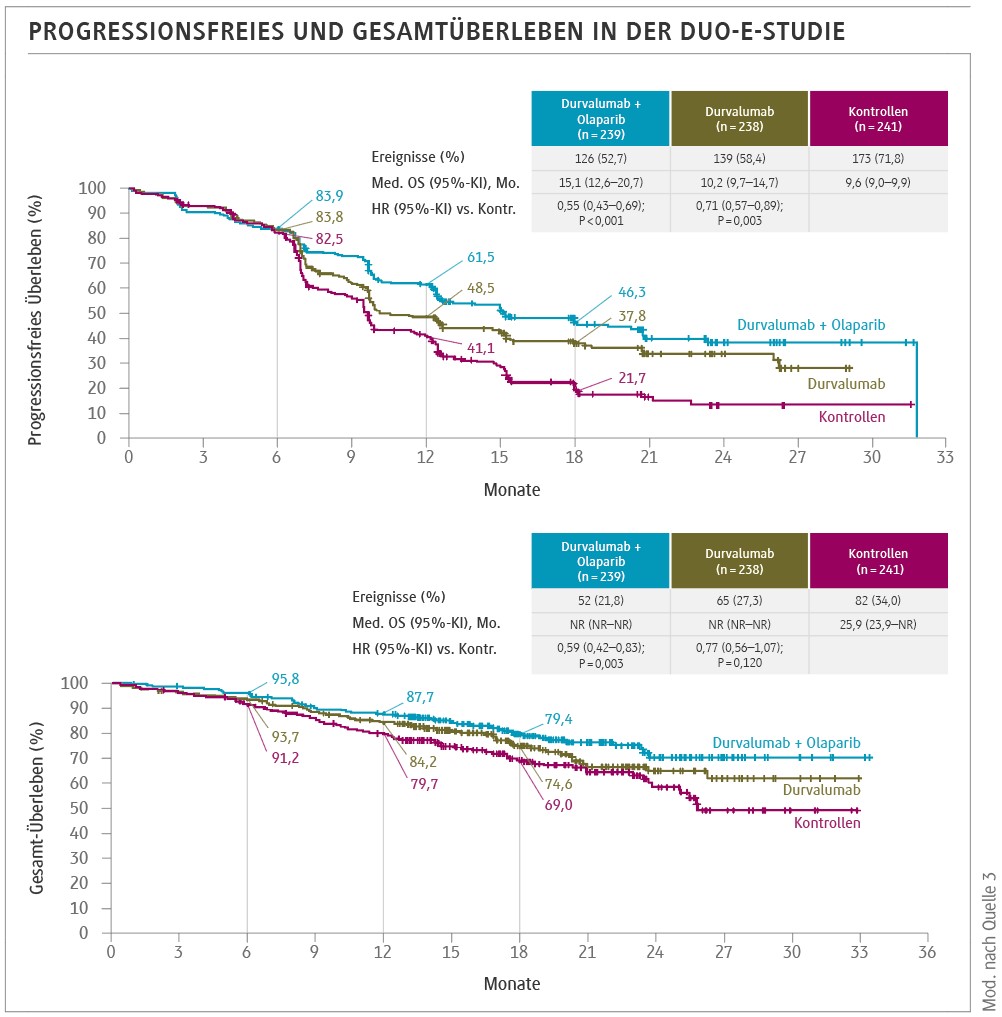
DUO-E-Trial
Neben präklinisch festgestellten Synergismen zwischen einer Standardchemotherapie und immuntherapeutischen Ansätzen gab es im Vorfeld auch Hinweise, dass der zusätzliche Einsatz von PARP (Poly-ADP-Ribose-Polymerase)-Inhibitoren zusätzlich tumorwirksam in der Behandung des fortgeschrittenen oder rezidivierten Endometriumkarzinoms sein könnte [3]. Mit dieser Rationale entwickelte das Autorenteam der DUO-E-Studie eine multizentrische, prospektiv-randomisierte klinische Studie, die sowohl die Kombination des PD-L1-Inhibitors Durvalumab als auch des PARP-Inhibitors Olaparib in die Standardchemotherapie des fortgeschrittenen oder rezidivierten Endometriumkarzinoms vorsahen [4].
In einem 1:1:1-Studiendesign wurden die Patientinnen entweder einer Chemotherapie bestehen aus 6 Zyklen Carboplatin AUC 5 und Paclitaxel 175 mg/m² plus einem Durvalumab-Placebo, jeweils q22, gefolgt von einem Olaparib-Placebo als Maintenance-Therapie mit 2 Tabletten täglich über 24 Monate zugeteilt (Kontrollgruppe).
Verglichen damit wurde ein experimenteller Therapiearm mit 6 Zyklen Carboplatin AUC 5 und Paclitaxel 175 mg/m² plus Durvalumab 1 120 mg q22, gefolgt von einer Therapie mit Durvalumab- mit 1 500 mg und einem Olaparib-Placebo als Maintenance mit 2 Tabletten täglich über 24 Monate (Durvalumab-Arm).
Ein weiterer, experimenteller Vergleichsarm bestand aus 6 Zyklen einer Standardchemotherapie mit Carboplatin AUC 5 und Paclitaxel 175 mg/m² plus Durvalumab q22, gefolgt von einer Maintenance-Therapie mit 2 × 300mg/die Olaparib (Durvalumab plus Olaparib-Arm). Das PFS bildete den primären Studienendpunkt.
In diese Studie wurden insgesamt 718 Patientinnen eingebracht. Dabei zeigte sich ein signifikanter PFS-Vorteil für die Patientinnen in der Durvalumab-Gruppe (HR 0,71; 95%-KI 0,57–0,89; p = 0,003) sowie für die Patientinnen in der Durvalumab plus Olaparib-Gruppe (HR 0,55; 95%-KI 0,43– 0,69; p < 0,0001), jeweils verglichen mit der Kontrollgruppe.
Besonders interessant waren darüber hinaus aber die Ergebnisse einer explorativen Subgruppenanalyse, die hinsichtlich des dMMR/pMMR-Befundes diskrimierte (Abb.):
Patientinnen mit dMMR-Befund:
Patientinnen mit pMMR-Befund
Patientinnen mit PD-L1-positivem Befund
Die Daten zur Beurteilung des overall survivals waren zum Zeitpunkt der Publikation der Arbeit noch nicht reif für eine abschließende statistische Auswertung. Was die Verträglichkeit anging, so bewegten sich die Ergebnisse innerhalb der Erwartungen für die jeweiligen Einzelsubstanzen.
Zusammengefasst konnte das Autorenteam mit ihrer Studie zeigen, dass die Hinzunahme des PD-L1-Inhibitors Durvalumab zu einer Standardchemotherapie, sowohl mit als auch ohne einer Erhaltungstherapie mit Olaparib, zu einer klinisch relevanten, statistisch signifikanten Verbesserung des PFS führt.
In der Folge wurde Durvalumab für die Erstlinien-Therapie des fortgeschrittenen oder rezidivierten Endometriumkarzinoms in der Kombination mit Carboplatin und Paclitaxel zugelassen. Darüber hinaus erhielt Durvalumab die Zulassung als Monotherapie im Sinne einer Maintenance im Nachgang nach genannter Kombinationstherapie für Patientinnen mit dMMR-Tumorbefund. Bei Patientinnen mit MMR-profizienten Tumoren wurde im Nachgang nach einer Kombinationschemotherapie eine Erhaltungstherapie bestehend aus Durvalumab und Olaparib zugelassen.

Die Integration eines Checkpoint-Inhibitors ist neuer Standard für die Behandlung von Patientinnen mit fortgeschrittenem oder rezidiviertem Endometriumkarzinom. Hierzu liegen jetzt prinzipiell Zulassungen für Pembrolizumab, Dostarlimab sowie Durvalumab vor.
Je nach molekularpathologischem Subtyp sowie dem Nebenwirkungsspektrum kann anhand der vorliegenden Daten der individuell zu favorisierende Immuncheckpoint-Inhibitor gefunden werden. Für Patientinnen mit MMR-profizientem Tumor gibt es darüber hinaus die Möglichkeit, zusätzlich Olaparib in die Maintenance-Therapie zu integrieren.

Der Autor

Prof. Dr. med. Michael Eichbaum
MHBA, Direktor der Klinik für Gynäkologie und Gynäkologische Onkologie
Helios Dr. Horst Schmidt Kliniken, Wiesbaden
Die Autorin

Dr. med. Christine Eichbaum
Oberärztin der Klinik für Frauenheilkunde und Geburtshilfe
Helios Dr. Horst Schmidt Kliniken
65199 Wiesbaden
Bildnachweis: privat