

Ein Überblick über Dermatosen, die man sich auf Reisen zuzieht, ist nutzbringend: zuerst wegen der Zunahme an Fernreisenden, die seit den Ausgangssperren und Reiseverboten zur Zeit der COVID-Pandemie wieder auf die Werte der Vorjahre gestiegen ist, aber auch wegen der zunehmenden Zahl an Menschen aus anderen Ländern, die bei uns Schutz vor Verfolgung oder aussichtsloser Armut suchen und aus ihrer Heimat Erkrankungen mitbringen, die wir medizinisch fachgerecht betreuen möchten.
Dermatosen machen ungefähr ein Viertel der Erkrankungen bei Reisenden aus und sind – nach Durchfall und jedwedem Fieber – der dritthäufigste Anlass für einen Arztbesuch nach Rückkehr [1].
Als erste fallen uns die vielfältigen Infektionen oder Infestationen ein, die man sich in fernen Ländern zuziehen kann und von denen einige bei uns selten sind. Doch beachtet werden muss, dass Reisedermatosen zum Beispiel auch ungewöhnliche allergische oder toxische Kontaktekzeme beinhalten wie sie Berührungen mit der Pflanzen- und Tierwelt zu Lande und zu Wasser mit sich bringen.
Diese Übersicht legt ihren Fokus auf Infektionen oder Infestationen – und da einmal auf die beiden häufigsten Hautinfektionen, die exklusiv auf Reisen erworben werden, und zum anderen auf die Infektionen, die auch in unseren Breiten vorkommen, aber auf Reisen deutlich häufiger.
In Deutschland lautet die Rangfolge der eingeführten Reisedermatosen gemäß einer jüngeren Erhebung [2]: Larva migrans (49 %), kutane Leishmaniasis (31 %), Myiasis (8–9 %) und Filariose sowie Lepra (je 4 %). Lepra nimmt indes eine Sonderstellung ein, denn sie gehört streng genommen nicht zu den Reisedermatosen, da ein Reisender sie sich kaum zuziehen wird, selbst wenn er lange durch Endemiegebiete reist; doch jemand, der dort aufgewachsen ist und aus beruflichen oder persönlichen Gründen bei uns lebt, kann daran erkrankt sein, ohne dass die Krankheit bereits diagnostiziert wurde, und sich hier beim Arzt erstmals damit vorstellen.
Nicht zu vernachlässigen sind aber auch die auf Reisen erworbenen sexuell übertragenen Infektionen, die oft nicht als Reisedermatosen im engeren Sinn betrachtet werden. An sie muss bei Reiserückkehrern jeden geschlechtsreifen Alters mit entsprechender Symptomatik oder mit Erkrankungen im Anogenitalbereich immer gedacht werden – ebenso wie bei akuten fiebrigen Erkrankungen mit Pharyngitis eine akute HIV-Infektion erwogen werden muss.
Zuletzt hat auch ein Erreger von Hautmykosen in der Reisemedizin in diesem Zusammenhang von sich reden gemacht: Trichophyton mentagrophytes Typ VII, auch „Thailand-Pilz“ genannt. Die Infektionen mit ihm sind hochentzündlich mit erythematösen, subkutan lokalisierten Plaques, Knoten und Pusteln, meist im Genitalbereich und oft schmerzhaft. Sie werden häufig zunächst als bakterielle Infektion oder Acne inversa fehldiagnostiziert. Der Erreger nahm von Asien seinen Ausgang, wird durch Intimverkehr übertragen und kann auch durch Intimrasur verbreitet werden. Eine Therapie mit Terbinafin ist wirksam, muss aber wegen der oft tiefen furunkuloiden Knoten bis zu 3 Monate durchgeführt werden und kann anfangs eine Verschlechterung im Sinne einer Herxheimer-Reaktion bedingen.
Ein weiterer wichtiger Hautpilz im Zusammenhang mit Fernreisen ist der hochresistente Trichophyton mentagrophytes Typ VIII (T. indotineae). Er hat sich in den vergangenen knapp 10 Jahren vom indischen Subkontinent aus über weite Teile der Welt verbreitet. Ein Großteil ist resistent gegenüber Terbinafin. An ihn als Erreger muss bei Reiserückkehrern gedacht werden, wenn es sich um angedeutet ringförmige Plaques mit konzentrisch angeordneten, schuppenden Rändern handelt oder eine Hautmykose therapierefraktär ist. Ursächlich für die Resistenz sind unterschiedliche Punktmutationen im Squalenepoxidase-Gen, die zum Teil zusätzlich auch schon eine geringere Empfindlichkeit gegenüber Itraconazol bedingen (bei Reiserückkehrern aus den arabischen Ländern oder vom indischen Subkontinent ist eine Resistenztestung daher ratsam). Es muss über 3 Monate kombiniert topisch mit Antimykotikaklassen wie Ciclopirox oder Amorolfin oder neueren Azolen (Sertaconazol) behandelt werden und gleichzeitig systemisch mit z. B. SUBA-Itraconazol (Itraconazol-Präparat mit verbesserter Bioverfügbarkeit; Cave: nur 2 × 50 mg). Wegen der zugleich hohen Ansteckungsfähigkeit sollten auch Kontaktpersonen untersucht werden.
Die beiden häufigsten Hautinfektionen, die – zumindest bislang noch – nur auf Reisen außerhalb Zentraleuropas erworben werden können, sind Larva migrans und kutane Leishmaniasis.
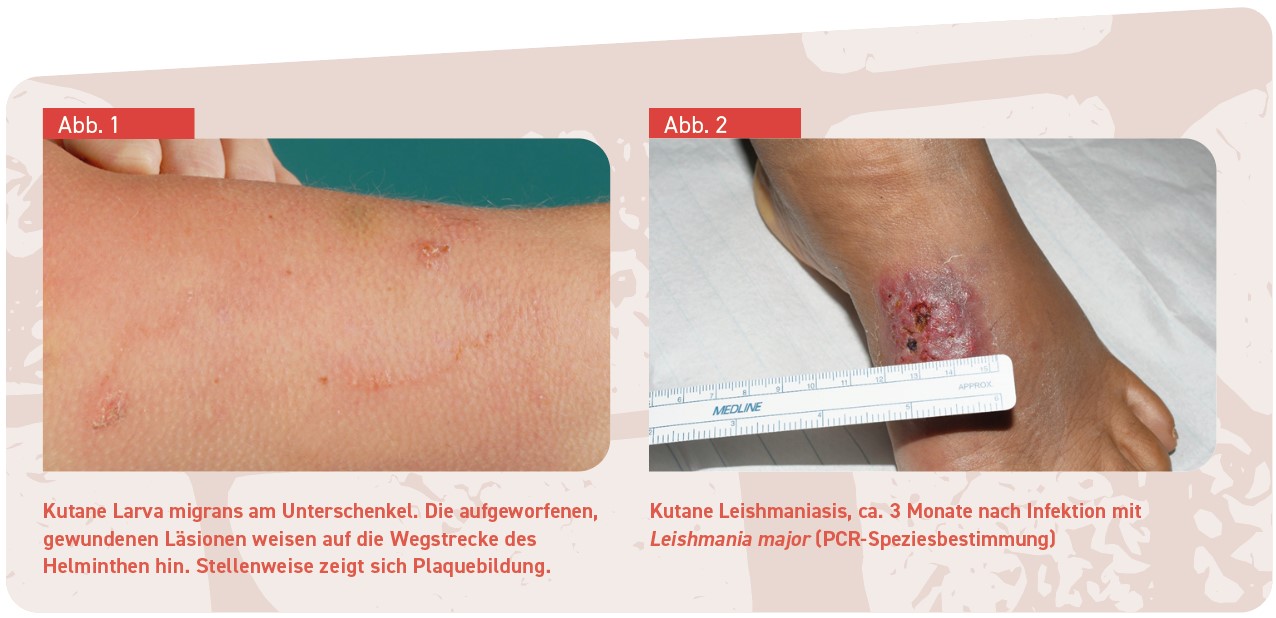
Larva migrans
Bei der kutanen Larva migrans dringen Nematodenlarven (meist Ancylostoma braziliense) in die intakte Epidermis exponierter Areale ein, vermutlich über Haarfollikel oder Schweißdrüsen, und bohren sich unter Hinterlassung charakteristisch gewundener Gänge durch die Epidermis (ca. 1 cm/Tag). Die kutane Larva migrans gehört zu den häufigsten importierten Hautkrankheiten im Zusammenhang mit Reisen und Migration. Weltweit soll sie 10 % der dermatologischen Diagnosen ausmachen. Sie ist endemisch in Gegenden mit warmfeuchtem Klima, in denen barfuß laufende Menschen mit Exkrementen freilaufender Tiere in Kontakt kommen (Strände in Südamerika, der Karibik, Afrika, Südostasien, den südöstlichen US-Staaten und teils am Mittelmeer).
Das klinische Bild ist typisch und erlaubt bei dazu passender Anamnese die Diagnosestellung. Nach Kontakt mit verseuchten Böden und einer Inkubationszeit von einigen Tagen entsteht am Infestationsort zunächst eine Papel, von der sich ein gewundener, erhabener Gang ausbreitet und der als Folge der Immunreaktion von roten Papeln begleitet wird (Abb. 1). Der quälende Juckreiz ist ebenfalls Ausdruck der Immunreaktion und kann schon auftreten, bevor die Gangstrukturen zu erkennen sind.
Die Erkrankung heilt zwar nach einiger Zeit von selbst aus, weil der Mensch Fehlwirt für die Hakenwurmlarven ist, aber eine Therapie sollte wegen des anhaltenden heftigen Juckreizes und des Risikos einer bakteriellen Infektion durchgeführt werden. Am wirksamsten und praktikabelsten ist die systemische Gabe von Ivermectin (1 × 200 µg/kg KG) [3,4]. Zur Milderung des Juckreizes wird begleitend eine 1- bis 5-tägige Lokaltherapie mit einer glukokortikoidhaltigen Creme empfohlen [3]. Ivermectin ist in Deutschland nicht für diese Indikation, aber für die Behandlung der Skabies zugelassen. Meist genügt die einmalige Einnahme, eine zweite Gabe kann gegeben werden, falls nach 10 Tagen keine Besserung eingetreten ist [3]. Laut Fachinformation sollen Kindern unter 15 kg kein systemisches Ivermectin erhalten, aber im Falle von Skabies oder Onchozerkose sind vielfach erfolgreiche Behandlungen auch in dieser Altersgruppe beschrieben und eine entsprechende Rezeptur für einen Saft mit adaptierter Dosierung veröffentlicht worden [5]. Nur falls bei ausgeprägtem Befall Ivermectin nicht verfügbar, wirksam oder verträglich ist, stellt die systemische Therapie mit Albendazol eine Alternative dar (2 × 400 mg/Tag oral für 3 Tage) [3]. Da dieses Medikament meist nur in Packungsgrößen mit 60 Tabletten abgegeben wird, ist die Therapie nicht kosteneffizient.
Wenn man weder systemisch Ivermectin oder Albendazol geben möchte oder wenn nur ein diskreter Befund vorliegt (nur eine Läsion, kein quälender Juckreiz), kann eine Lokaltherapie mit Albendazol (10 %) in lipophiler Grundlage erfolgen, z. B. 1 200 mg Albendazol (3 Tbl. à 400 mg) in Vaselinum album ad 12,0 g. Es sollte 3 × täglich für 7–10 Tage auf einem genügend großen Areal verteilt werden [3]. Ein erfolgreicher Off-Label-Einsatz topischen Ivermectins (zugelassen gegen Rosazea) ist bislang in Fallberichten und einer retrospektiven Erhebung berichtet worden [4,6]; hierzu fehlen aber entsprechende Studien.
Unter einer wirksamen Behandlung sollte der Juckreiz nach 3, die Dermatitis nach 7 Tagen deutlich rückläufig sein. Während der Schwangerschaft oder Stillzeit kann bislang nur die gegen den Juckreiz gerichtete 1- bis 5-tägige Begleittherapie mit glukokortikoidhaltigen Cremes empfohlen werden [3]. Ausdrücklich abzuraten ist von einer lokalen Behandlung mit Mebendazol oder einer Kryotherapie [3,4].
Präventiv sollten an Stränden, die in Endemieländern auch von Katzen und Hunden genutzt werden, Schuhwerk mit festen Sohlen (Sandalen) getragen und feste Unterlagen (Matratzen oder Liegen) anstelle von Handtüchern benutzt werden. Barfuß kann auf Strandarealen gelaufen werden, die regelmäßig von den Gezeiten gespült und kühl gehalten werden.

Kutane Leishmaniasis
Jährlich kommt es zu 1–1,5 Millionen Neuerkrankungen an kutaner Leishmaniasis (90 % davon in Afghanistan, Algerien, Saudi-Arabien, Sudan, Brasilien und Peru). Eine kutane Leishmaniasis zieht man sich nicht selten auch im Landesinneren von Mallorca zu (Leishmania infantum) – und nicht immer verläuft die dort akquirierte Hautinfektion unter Bildung des sonst oft typischen Ulkus. Die unterschiedlichen klinischen Manifestationen dieser häufigen Reisedermatose liegen auch an den verschiedenartigen Spezies und den verschiedenen Subgenera Leishmania und Viannia (diese genetisch unterschiedlichen Leishmanien der Alten und Neuen Welt wurden wahrscheinlich seit der Aufbrechung des Großkontinentes Gondwana und Abwanderung der südamerikanischen Platte getrennt).
Eine bündige Abhandlung der kutanen und mukokutanen, geschweige denn der viszeralen Leishmaniasis innerhalb dieser Übersicht ist nicht möglich, daher hier eine kurze Darstellung beachtenswerter Hinweise für die Praxis (s. auch S. 14–16).
Übertragen werden die (promastigoten) Leishmanien durch den Stich infizierter Sandmücken (Alte Welt: Gattung Phlebotomus, Neue Welt: Gattung Lutzomyia). Diese abends aktiven Insekten sind nicht die kräftigsten oder sich hoch vom Erdboden abhebenden Flieger, sodass eine Infektion in Wohnungen oberhalb des Erdgeschosses weniger wahrscheinlich wird – hier sollte man also nach Möglichkeit schlafen und sich abends auf der Terrasse gut vor diesen kleinen Mücken (und anderen Insekten) schützen.
In der Alten Welt sind Leishmanien im Nahen Osten sowie Mittelmeerraum (z. B. Balearen, spanische Mittelmeerküste) und in Nordafrika verbreitet. Vertreter sind hier das Subgenus Leishmania (L.) mit z. B. den Spezies L. major, L. tropica und L. infantum (letztere gehört indes zum L.-donovani-Komplex, dessen Spezies insbesondere auch die viszerale Leishmaniasis verursachen [7].
Mehrere Wochen nach Infektion entsteht im typischen Fall ein Ulkus mit hyperkeratotischem, erhabenen Rand (oft „kraterförmig“) (Abb. 2), das ohne Behandlung zwar nach einigen Monaten abheilt, stets aber unter Hinterlassung einer Narbe. Vor allem im Falle von L. infantum (z. B. aus dem Landesinneren Mallorcas, wo fast alle Hunde infiziert sind – und mitreisende Hunde infiziert werden), können auch Knoten oder Plaques ohne Ulkus auftreten; dann ist die Diagnosestellung nicht leicht und erfolgt oft erst aufgrund der Histologie. Im Nachhinein kann sie noch über eine PCR aus dem in Paraffin eingebetteten Gewebe gesichert und um eine Speziesidentifizierung ergänzt werden.
Ansonsten kann die Diagnose bei Erscheinen eines typischen Ulkus auf exponiertem Hautareal, aufgetreten mehrere Wochen nach Aufenthalt in einem Endemiegebiet, vermutet sowie histologisch bestätigt werden und sollte möglichst stets um eine Bestimmung der Leishmanienspezies vervollständigt werden, da letztere wichtig für die entsprechende Therapie ist. Sie erfolgt über eine PCR aus Gewebe (am besten nativ, aber auch Formalin-fixiert) oder zusätzlich eine Anzüchtung von Leishmanien aus nativem Gewebe – alles möglichst in einem Labor mit entsprechender Expertise [7].
Der Verlauf ist meist unkompliziert, je nach Immunstatus und Lokalisation der Infektion kann er aber auch komplex sein (z. B. Satelliten oder gar systemischer Verlauf wie bei L. infantum) und bedarf dann dringender Therapie [8,9].
Bei Infektionen mit dem Subgenus Viannia (V.) (z. B. L. V. braziliensis) in Zentral- und Südamerika kann sich nach der kutanen Infektion in ca. 1–5 % der Fälle über eine Streuung der Parasiten in die nasale oder auch orale Schleimhaut eine zerstörerische Immunreaktion entwickeln (die mutilierende mukokutane Verlaufsform) [10].
Die Behandlung richtet sich nach den genannten Umständen. Komplexe Läsionen (Einzelläsion > 4 cm, kosmetisch/funktionell beeinträchtigende Areale, Haut-Schleimhaut-Übergänge; Lymphangitis/Lymphadenitis, Satellitenherde) oder kutane Infektionen mit Subgenus Viannia oder mukokutane Verlaufsformen (wie viszerale Leishmaniasis) machen eine systemische Therapie notwendig. Hierfür stehen je nach Spezies v. a. Miltefosin (einziges für Leishmaniasis in Deutschland zugelassenes Medikament) und liposomales Amphotericin B zur Verfügung. Einzelne kutane Herde mit Erregern aus der Alten Welt (inkl. der von den Kolonialisten importierten L.-mexicana-Infektion aus Mittel- oder Südamerika) können ausreichend mit Lokaltherapien behandelt werden. Hierfür gibt es – teilweise speziesabhängig – mehrere Möglichkeiten: Thermotherapie, photodynamische Therapie, Paromomycin 15 %/Methylbenzethoniumchlorid 12 % (v. a. bei L. major), Ulkusbehandlung mit filmbildendem Hydrogel (mit 0,045 % Natriumchlorit [NaClO2]; kostengünstig), Kryotherapie und eher selten die periläsionale Injektion von Antimon [7].
Die meisten Therapien werden in der Leitlinie beschrieben [7]; sie soll bald in eine aktualisierte Form überführt werden – wegen der Komplexität allerdings kein geringes Unterfangen.
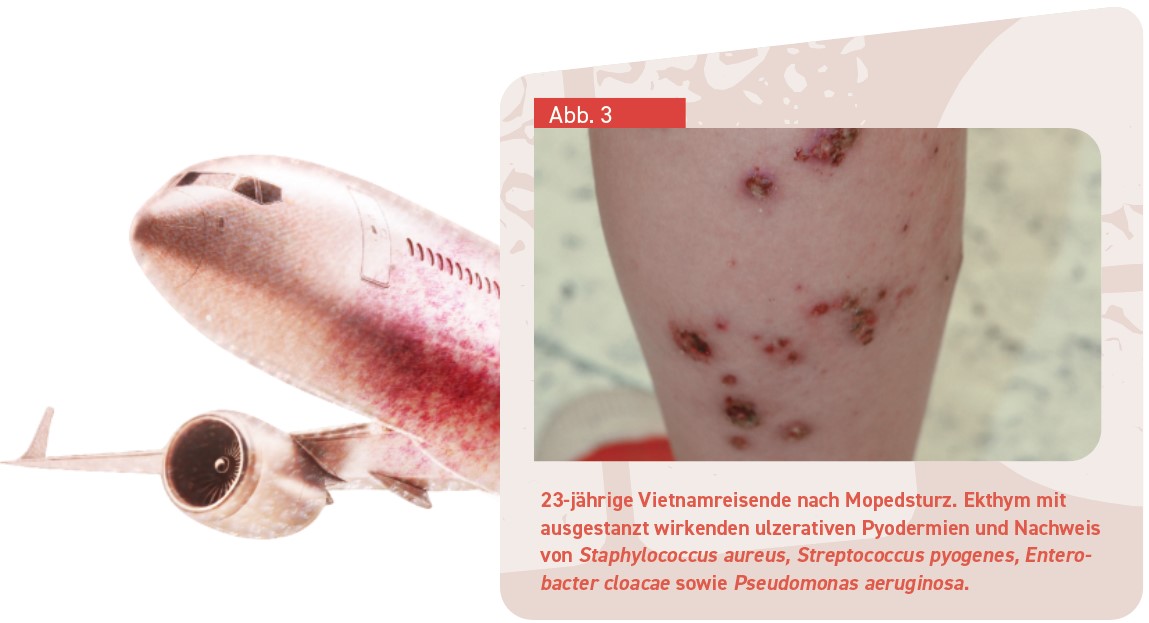
Ekthym und Weichgewebeinfektionen
Bestimmte auch hierzulande gängige oder zumindest bekannte Infektionen kommen unter besonderen klimatischen oder hygienischen Verhältnissen häufiger vor. Beispiele dafür sind das Ekthym und Haut- und Weichgewebeinfektionen. Beim Ekthym handelt es sich gleichsam um eine ulzerierende Form der Impetigo beim Erwachsenen (Abb. 3), hervorgerufen durch β-hämolysierende Streptokokken und mitunter auch Staphylococcus (S.) aureus. Begünstigend wirkt die im feuchtwarmen Klima erhöhte Erregerdichte auf der Haut, zusätzlich gefördert z. B. durch okklusive Kleidung auf Reisen. Die starke Hydratation der Epidermis und kleine Schädigungen, die auf Reisen häufiger sind, u. a. durch Abschürfungen, mechanische Blasen an den Füßen, Erosionen nach Bläschen durch Herpes simplex oder Kratzexkoriationen wegen der – im Urlaub oft zahlreichen – Insektenstiche oder infolge atopischer Dermatitis. Ob die Bakterien direkt durch Insektenstiche übertragen werden, ist nicht bekannt.
Wenn S. aureus in Endemiegebieten wie den USA oder in Ostasien zu den Panton-Valentine-Leukozidin(PVL)-Bildnern gehört, dann genügt das alleine schon für die Entstehung eines Ekthyms oder von Weichgewebeinfektionen.
Die akute Poststreptokokken-Glomerulonephritis tritt v. a. bei Infektionen mit Streptokokken der Serotypen 1, 4, 12 und 25 auf. Ihr Auftreten ist in Deutschland und wahrscheinlich in Zentraleuropa in den vergangenen 10 Jahren nicht vermeldet worden und daher nicht mehr in aller Bewusstsein, aber in den Endemiegebieten wie dem vorderen Orient ist sie eine bekannte Komplikation, z. B. bei Impetiginisierung der dort häufigen Skabies-bedingten Ekzeme.
Klinisch bildet sich beim Ekthym meist aus einer Pustel ein Ulkus mit scharf begrenzten, ausgestanzt wirkenden Rändern, oft hämorrhagischer Kruste mit umgebendem Erythem, das sich binnen weniger Tage auf eine Größe von bis zu 1–3 cm ausdehnt und dann verharrt. Bei entsprechenden Hinweisen (Furunkel; rapider Beginn und schnelle Ausbreitung auf sonst unauffälliger Haut bei gesunden Jugendlichen/Erwachsenen; evtl. zusätzlich Nekrosen oder beginnende Phlegmone; Auftreten nach Aufenthalt in Endemieländern wie den USA) sollte eine Bestimmung des PVL erfolgen [11]. Klinische Differenzialdiagnosen des Ekthyms sind in der Tabelle aufgeführt.
Bei gleichzeitig vorliegenden Follikulitiden sollte nach deren Ursache gefahndet werden (z. B. Myiasis bei entsprechenden Reiseländern).
Die Therapie erfolgt mit Cefadroxil oder Cefalexin oral – bei Nachweis von nur hämolysierenden Streptokokken reicht Phenoxymethylpenicillin/Penicillin V – oder mit Cefazolin parenteral. Bei dringendem Verdacht auf CA-MRSA bietet sich Trimethoprim/Sulfamethoxazol (Cotrimoxazol) für die kalkulierte
Therapie an. Zusätzlich werden eine gründliche Körperhygiene und das Waschen der Kleidung und Bettwäsche möglichst bei mindestens 60 °C empfohlen.
Neben dem Ekthym sind bei Reisenden auch andere bakterielle Haut- und Weichgewebeinfektionen (HWGI) häufiger, meist aus ähnlichen Gründen. Das durch Streptokokken verursachte Erysipel erkennt man an einem bogig begrenzten, teils glänzenden Erythem, das zu Beginn stets von Allgemeinsymptomen begleitet wird. Die Therapie der Wahl ist Penicillin. Die unkomplizierte (begrenzte) Phlegmone ist eine nicht oder nur wenig eiternde Infektion der Dermis und Subkutis, die häufig von Wunden oder einem Ekthym ihren Ausgang nimmt. Sie wird meist durch S. aureus verursacht und erscheint als ödematöse, bedingt schmerzhafte, livide Rötung bzw. teigige Schwellung um die Eintrittspforte herum. Das Erythem ist im Gegensatz zum Erysipel matter, livider und unschärfer begrenzt, die Schwellung ödematöser, und die Allgemeinsymptomatik initial seltener und weniger ausgeprägt. Die Behandlung umfasst initial Cephalosporine der Generation 1 und 2 (oder Flucloxacillin i. v.), zusätzlich zu einer adäquaten Wundversorgung. In Endemiegebieten für PVL-bildende S. aureus muss evtl. Trimethoprim-Sulfamethoxazol gegeben werden. Abgegrenzt werden müssen a) die selteneren komplizierten Phlegmonen, bei denen bestimmte die lokale oder systemische Immunantwort beeinträchtigende Komorbiditäten vorliegen und bei denen das Erregerspektrum daher breiter ist, und b) die nekrotisierenden Weichgewebeinfektionen, die aufgrund Toxin-bedingter Ischämie und Schocksymptomatik fulminant verlaufende Infektionen darstellen und der sofortigen, umfassenden chirurgischen und oft auch intensivmedizinischen Versorgung bedürfen. Ihre Erkennungszeichen sind heftigste Schmerzen, ausgeprägte, über das erythematöse Areal hinausgehende Ödeme, Bewegungseinschränkungen und mitunter eine retiforme Purpura auf der Haut. Hervorzuheben sind hier als Reisedermatose Infektionen durch Aeromonas (A.) spp., (insbesondere A. hydrophila), und Vibrio (V.) spp. (V. vulnificus, V. alginolyticus, V. parahaemolyticus) bei Wunden mit Salz- oder Brackwasserexposition und meist Hepatopathie oder Immunsuppression. Als Antibiotika werden hier Doxycyclin zusammen mit Ceftriaxon i. v. empfohlen.

Der Autor

Prof. Dr. med. Cord. Sunderkötter
Direktor der Universitätsklinik und Poliklinik für Dermatologie und Venerologie, Medizinische Fakultät der Martin-Luther-Universität
Halle-Wittenberg
Bildnachweis: Tanicsean (Adobe Stock); Dr. med. Viktor A. Czaika, privat, Fotoabteilung, Klinik für Dermatologie, Universitätsklinikum Münster, Klinik für Dermatologie Universitätsklinikum Halle