
Inkretinmimetika haben einen Paradigmenwechsel im Kontinuum des CKM-Syndroms eingeläutet. Folglich sollte das Zusammenspiel von Herz, Niere, Stoffwechsel und Immunsystem organübergreifend gedacht und interdisziplinär behandelt werden.
Inkretinmimetika stehen zunehmend im Fokus. Sie verbessern die Blutzuckerkontrolle, fördern Gewichtsreduktion und senken kardiovaskuläre Ereignisse unabhängig vom Glucoseeffekt. Doch was genau verbirgt sich hinter diesen Substanzen? Im Folgenden wird der Einsatz von GLP-1-Rezeptoragonisten in der klinischen Praxis näher beleuchtet.
Vom Darm zum Herzen: die vielseitige Wirkung von GLP-1
Das Glucagon-like Peptid-1 (GLP-1) gehört zur Gruppe der Inkretinhormone. Es wird in den L-Zellen des Darms synthetisiert und entfaltet seine Wirkung durch Bindung an GLP-1-Rezeptoren, die in verschiedenen Organen exprimiert sind. Zu den zentralen physiologischen Effekten von GLP-1 zählen die glucoseabhängige Stimulation der Insulinsekretion, die Verzögerung der Magenentleerung sowie die Förderung des Sättigungsgefühls und die Verminderung des Hungergefühls [1].
Aufgrund dieser Effekte werden Inkretinmimetika wie GLP-1-Rezeptoragonisten (GLP-1-RA), die die Effekte des endogen produzierten GLP-1 nachahmen, u. a. zur Therapie des Typ 2 Diabetes mellitus (T2DM) sowie der Adipositas eingesetzt. Darüber hinaus weisen Daten darauf hin, dass GLP-1-RA zusätzliche Effekte besitzen, die über die reine Blutzuckersenkung und Gewichtsreduktion hinausgehen und vorteilhaft für Patientinnen und Patienten mit kardiovaskulären Erkrankungen sind [2].
Das CKM-Syndrom – Herz, Niere und Stoffwechsel gemeinsam gedacht
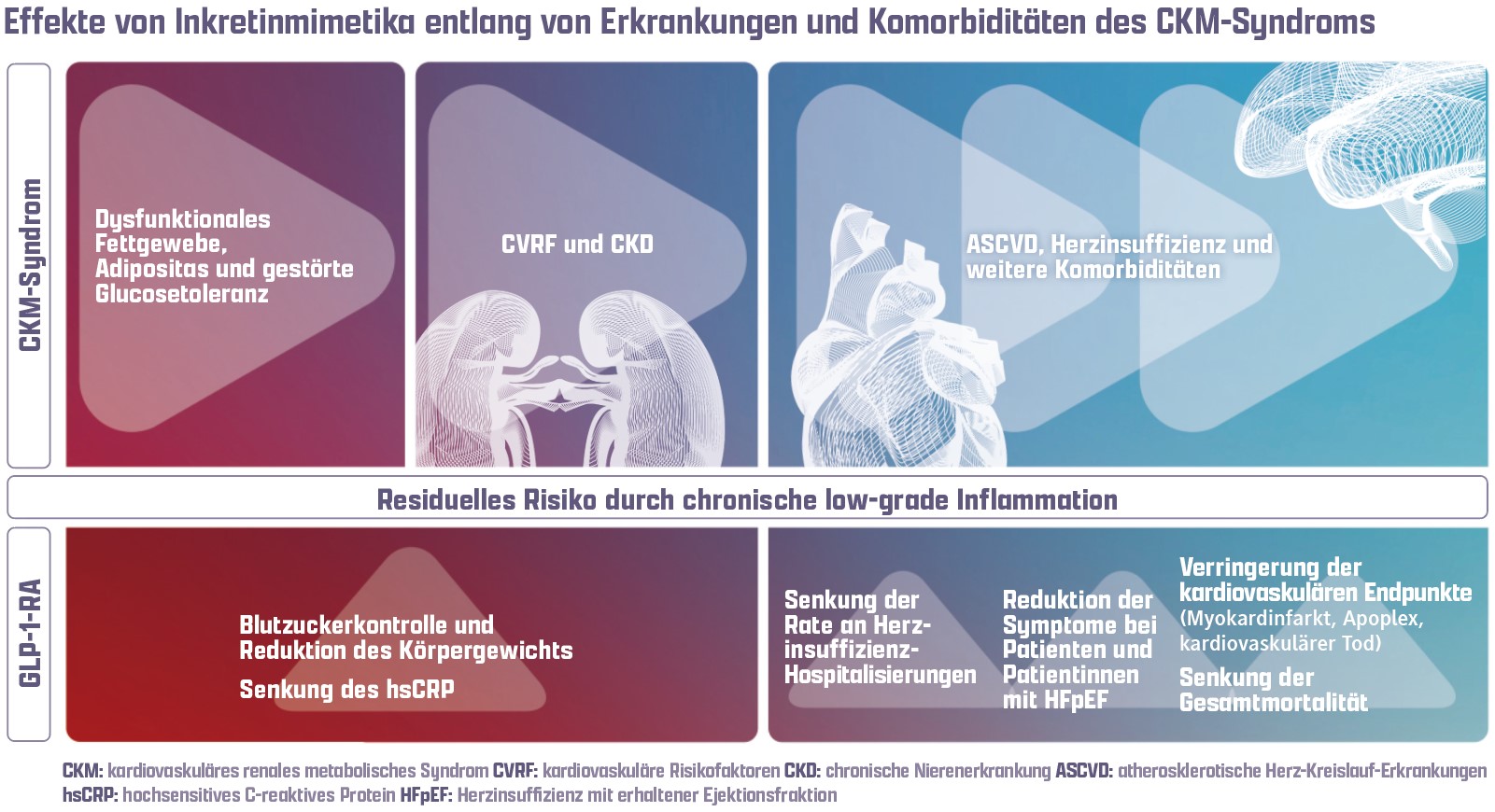
Das metabolische Syndrom beschreibt die Kombination mehrerer Risikofaktoren – darunter Adipositas, arterielle Hypertonie, Dyslipidämie und Insulinresistenz – die gemeinsam das Risiko für die Entwicklung kardiovaskulärer Erkrankungen signifikant erhöhen. Die Bedeutung dieser Risikofaktoren wurde in großen prospektiven Kohortenstudien wie der Framingham-Studie zuvor eindrücklich belegt [3]. Ein enger Zusammenhang besteht zudem zwischen Herz und Niere: Bei etablierter kardiovaskulärer Erkrankung entwickelt sich im weiteren Verlauf in vielen Fällen eine Nierenerkrankung. Wichtig ist jedoch auch, dass die chronische Niereninsuffizienz einen unabhängigen Risikofaktor für die Entwicklung kardiovaskulärer Erkrankungen darstellt und bei Vorliegen von sowohl kardialen als auch renalen Pathologien Morbidität und Mortalität deutlich erhöht sind [4]. Ein Begriff, der diese pathophysiologischen Zusammenhänge in einem klinischen Kontext zusammenführt und greifbar macht, ist das Cardiovascular-Kidney-Metabolic Syndrome (CKM-Syndrom) [5]. Das CKM-Syndrom beschreibt ein Kontinuum bestehend aus 4 Stadien, dem dysfunktionales Fettgewebe und gestörte Glucosetoleranz als Risikofaktoren zugrunde liegen (Stadium I). Im weiteren Verlauf entwickeln sich Risikofaktoren des metabolischen Syndroms oder die chronische Niereninsuffizienz (Stadium II), die durch Wechselwirkungen dann das Auftreten von subklinischen kardiovaskulären Erkrankungen begünstigen (Stadium III). Am Ende steht die klinisch apparente kardiovaskuläre Erkrankung in Form von Herzinsuffizienz, Vorhofflimmern, koronarer Herzkrankheit, Schlaganfall oder peripherer arterieller Verschlusskrankheit (Stadium IV) [5].
Angesichts der engen pathophysiologischen Verknüpfung zwischen kardiovaskulären Erkrankungen, Adipositas, Diabetes mellitus und chronischer Nierenerkrankung ist es für die Behandlung dieser Erkrankungen vorteilhaft, Wirkstoffe zu identifizieren, die als therapeutische Zielstruktur eine oder mehrere Komponenten, die Teil des CKM-Syndroms sind, zu behandeln. Eine besonders relevante Wirkstoffklasse in der kardiologischen Praxis stellen dabei die Inkretinmimetika dar.
Im Folgenden wird der Einsatz von GLP-1-RA bei 3 Krankheitsbildern näher betrachtet, die eine zentrale Rolle im Zuge des CKM-Syndroms einnehmen: dem T2DM, der Adipositas und der Herzinsuffizienz.
GLP-1-RA bei Typ 2 Diabetes mellitus
Die Inzidenz des T2DM hat über die vergangenen Jahrzehnte deutlich zugenommen, weshalb er eine globale medizinische Herausforderung darstellt [6]. Betroffene Patientinnen und Patienten haben über die Dauer der Erkrankung ein hohes Risiko, mikro- und makrovaskuläre Komplikationen zu erleiden. Groß angelegte Untersuchungen wie die „The Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation“ (ADVANCE) oder „The Action to Control Cardiovascular Risk in Diabetes“ (ACCORD) Studien zeigten keinen Vorteil einer forcierten Blutzuckersenkung im Hinblick auf kardiovaskuläre Endpunkte. Striktere Blutzuckerkontolle führte jedoch zu einem signifikant höheren Risiko, Hypoglykämien zu erleiden [7,8]. Mitunter zeigten sich Hinweise auf ein erhöhtes Auftreten von ungünstigen Endpunkten. Die U.S. Food and Drug Administration (FDA) forderte daher für alle neu zugelassenen antidiabetischen Substanzen, den Nachweis von kardiovaskulärer Sicherheit zu erbringen [9]. In der Folge wurden zahlreiche Studien für neue Wirkstoffe initiiert, die deren Sicherheit hinsichtlich kardiovaskulärer Endpunkte beweisen mussten.
Überraschend waren dann die ersten Ergebnisse zu Sodium-glucose linked transporter 2(SGLT2)-Inhibitoren, in denen nicht nur Sicherheit, sondern positive Effekte auf kardiovaskuläre Endpunkte nachgewiesen werden konnten [10]. Eine weitere Substanzklasse mit Nachweis von Reduktion kardiovaskulärer Ereignisse waren GLP-1-RA. Beginnend mit der „Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Outcome Results“ (LEADER) Studie wurde erstmals bei Patientinnen und Patienten mit T2DM unter Einnahme des täglich zu applizierenden GLP-1-RA Liraglutid eine signifikante Reduktion des kombinierten Endpunkts, bestehend aus kardiovaskulärem Tod, nicht-tödlichem Herzinfarkt und nicht-tödlichem Schlaganfall (major adverse cardiovascular events, MACE) demonstriert [11]. In den Folgejahren wurde im Anschluss für die wöchentlich applizierbaren Substanzen Semaglutid („Trial to Evaluate Cardiovascular and Other Long-term Outcomes with Semaglutide in Subjects with Type 2 Diabetes“ [SUSTAIN-6]) und Dulaglutid („Researching Cardiovascular Events With a Weekly Incretin in Diabetes“ [REWIND]) ebenfalls eine Reduktion von MACE bei Patientinnen und Patienten mit T2DM nachgewiesen [12-13].
In den aktuellen Leitlinien der Europäischen Gesellschaft für Kardiologie (European Society of Cardiology, ESC) zum Management kardiovaskulärer Erkrankungen bei Patienten und Patientinnen mit Diabetes nehmen deshalb sowohl SGLT2-Inhibitoren als auch GLP-1-RA eine zentrale Rolle in der Therapie des T2DM mit kardiovaskulären Begleiterkrankungen ein [14]. Es besteht eine Klasse-I-Empfehlung zum Einsatz von GLP-1-RA bei Patientinnen und Patienten mit T2DM und bekannter atherosklerotisch kardiovaskulärer Erkrankung (atherosclerotic cardiovascular disease, ASCVD). Hierbei ist es wichtig, dass diese Empfehlung unabhängig von der Blutzuckerkontrolle besteht. Das bedeutet, dass GLP-1-RA bei allen Patientinnen und Patienten mit T2DM und ASCVD verwendet werden sollten, unabhängig von der Einstellung des Langzeitblutzuckers [14].
GLP-1-RA bei Adipositas
In den vergangenen Jahren hat ein Umdenken stattgefunden – denn das Verständnis darüber, dass die Adipositas keinen charakterlichen Kontrollverlust, sondern eine komplexe Multisystemerkrankung darstellt, ist deutlich gewachsen [15]. Dysfunktionales Fettgewebe stellt einen zentralen Treiber des CKM-Syndroms dar und die manifeste Adipositas erhöht das Risiko für kardiovaskuläre Ereignisse deutlich [16,17].
Die Behandlung von Adipositas beginnt mit strukturierten Lebensstilinterventionen. Das Ziel einer dauerhaften Gewichtsreduktion ist hierunter jedoch oft nicht erreichbar, weshalb pharmakologische Ansätze zur Adressierung der Adipositas seit langer Zeit Gegenstand der Forschung sind. Ältere Medikamente waren durch Verträglichkeit und Sicherheit begrenzt. Mit Inkretinmimetika stehen nun jedoch wirksame Optionen zur Verfügung, die bei Adipositas zu einer klinisch relevanten Gewichtsabnahme führen [18].
In der jüngst publizierten Arbeit „A Research Study to See How Semaglutide Helps People With Excess Weight, Lose Weight“ (STEP-UP) wurde mit dem GLP-1-RA Semaglutid eine Gewichtsreduktion von im Durchschnitt 18,7 % bei Patienten und Patientinnen mit einem Body-Mass-Index (BMI) von 30 kg/m2 oder größer ohne vorbestehenden T2DM erzielt [19]. Diese Ergebnisse sind vergleichbar mit der Gewichtsreduktion, die unter Chirurgie (z. B. Magenband) erzielt werden kann.
Im Weiteren stellt sich die Frage, ob auch Patientinnen und Patienten mit Adipositas, jedoch ohne T2DM, von den zuvor beschriebenen kardioprotektiven Effekten der GLP-1-RA profitieren und kardiovaskuläre Endpunkte außerhalb des T2DM verbessert werden können. Die erste Arbeit, die dieser Fragestellung nachgegangen ist, war die „Semaglutide Effects on Cardiovascular Outcomes in People with Overweight or Obesity“ (SELECT) Studie [20]. In SELECT konnte erstmals eine signifikante Reduktion kardiovaskulärer Ereignisse (MACE) bei insgesamt 17 604 Patientinnen und Patienten mit kardiovaskulärer Erkrankung und einem BMI von ≥ 27 kg/m2, jedoch ohne vorbestehenden T2DM, nachgewiesen werden [20]. Auf Grundlage dieser Evidenz empfehlen die ESC-Leitlinien für das Management des chronischen Koronarsyndroms (chronic coronary syndrome, CCS) aus 2024 den Einsatz von Semaglutid bei übergewichtigen (BMI ≥ 27 kg/m²) CCS-Erkrankten ohne T2DM zur Reduktion kardiovaskulärer Ereignisse [21].
Neben GLP-1-RA rücken diverse Weiterentwicklungen im Feld der Inkretinmimetika in den Fokus. Eine wichtige Neuerung stellt der duale Inkretin-Agonismus an Rezeptoren des glucoseabhängigen insulinotropen Peptids (GIP) und GLP-1 zugleich dar. Die Leitsubstanz dieser Wirkstoffgruppe – auch „Twincretins“ genannt – ist Tirzepatid, unter dem größere Reduktionen des Langzeitblutzuckers sowie des Körpergewichts beobachtet wurden als unter anderen GLP-1-RA [18].
Angelehnt an die Ergebnisse der SELECT-Studie wird aktuell in der laufenden „A Study of Tirzepatide (LY3298176) on the Reduction on Morbidity and Mortality in Adults With Obesity“ (SURMOUNT-MMO) Studie untersucht, ob kardiovaskuläre Endpunkte mit Tirzepatid bei Patientinnen und Patienten mit kardiovaskulären Erkrankungen und Adipositas, jedoch ohne T2DM, verbessert werden können [22]. Der Abschluss der Studie wird 2027 erwartet.
Trotz aktueller Empfehlungen in der S3-Leitlinie „Prävention und Therapie der Adipositas“ besteht in Deutschland derzeit noch keine Kostenübernahme durch die gesetzlichen Krankenkassen für den Einsatz von GLP-1-RA bei der Indikation Adipositas [23].
GLP-1-RA bei Herzinsuffizienz und Adipositas
Die Herzinsuffizienz ist eine der relevantesten Manifestationen der letzten Stufe des CKM-Syndroms. Insbesondere die Herzinsuffizienz mit erhaltener linksventrikulärer Ejektionsfraktion (heart failure with preserved ejection fraction, HFpEF) ist hierbei mit einigen kardiometabolischen Komorbiditäten assoziiert und betrifft weltweit bis zu 32 Millionen Menschen [24]. Je nach Quelle weisen etwa 50 % aller Patientinnen und Patienten mit Herzinsuffizienz eine HFpEF auf. Hohes Alter, das weibliche Geschlecht, arterielle Hypertonie, Adipositas, T2DM, Niereninsuffizienz, Vorhofflimmern und chronisch-obstruktive Lungenerkrankungen sind Faktoren, die häufig gemeinsam mit der HFpEF beobachtet werden [25].
SGLT2-Inhibitoren haben bereits aufgrund ihrer positiven Effekte innerhalb der vergangenen Jahre eine zentrale Rolle in der Therapie der Herzinsuffizienz eingenommen. Sie werden unabhängig von der Ejektionsfraktion bei allen Patientinnen und Patienten mit Herzinsuffizienz zur Reduktion von kardiovaskulärer Mortalität und Hospitalisierung für Herzinsuffizienz empfohlen [26].
Da die Adipositas und der T2DM pathophysiologisch eng mit der HFpEF verzahnt sind, wurde auf Grundlage dessen in den vergangenen Jahren untersucht, ob Patientinnen und Patienten mit HFpEF möglicherweise ebenfalls von den vorteilhaften Effekten der GLP-1-RA profitieren können.
In der Studie „Effect of Semaglutide 2.4 mg Once Weekly on Function and Symptoms in Subjects with Obesity-related Heart Failure with Preserved Ejection Fraction“ (STEP-HFpEF) führte die Behandlung mit Semaglutid in der HFpEF mit Adipositas, jedoch ohne vorbestehenden T2DM, zu einer signifikanten Verbesserung der Symptomatik und funktioneller Endpunkte [27]. Die Effekte von Tirzepatid in der HFpEF wurden in der „A Randomized, Double-Blind, Placebo-Controlled, Phase 3 Study Comparing the Efficacy and Safety of Tirzepatide versus Placebo in Patients with Heart Failure with Preserved Ejection Fraction and Obesity“ (SUMMIT) Studie untersucht (28). Hier wurde nicht nur die Verbesserung von Symptomatik, sondern auch eine Reduktion des kombinierten Endpunktes bestehend aus kardiovaskulärem Tod und Verschlechterung der Herzinsuffizienz unter Tirzepatid bei Patientinnen und Patienten mit HFpEF und Adipositas beobachtet. Auf dieser Basis ist zu erwarten, dass künftige Leitlinien zur Herzinsuffizienz womöglich auch Inkretinmimetika in ihren Therapieempfehlungen berücksichtigen werden.
Pleiotrope Effekte der Inkretinmimetika – kardiovaskuläre Inflammation als verbindendes Element
Neben traditionellen kardiovaskulären Risikofaktoren des metabolischen Syndroms tragen chronische und systemische, geringgradige („low-grade“) inflammatorische Prozesse massiv zum residuellen kardiovaskulären Risiko bei [29]. Insbesondere das beim CKM-Syndrom im Zentrum stehende dysfunktionale Fettgewebe fördert proinflammatorische Prozesse, die im Weiteren zur Entstehung metabolischer Risikofaktoren, zur Progression der chronischen Niereninsuffizienz, einer Potenzierung von Interaktionen zwischen Herz und Niere und zur Entwicklung kardiovaskulärer Erkrankungen beitragen [5].
Das hochsensitive C-reaktive Protein (hsCRP) ist der etablierteste Biomarker, um das residuelle inflammatorische Risiko von Patientinnen und Patienten zu erfassen [30]. Die „Inflammations-Hypothese“ zur Entstehung kardiovaskulärer Erkrankungen wurde in der Vergangenheit in den „The Canakinumab Antiinflammatory Thrombosis Outcome Study“ (CANTOS) und „Low Dose Colchicine for secondary prevention of cardiovascular disease“ (LoDoCo2) Studien untersucht [31,32]. In beiden Arbeiten konnten antiinflammatorische Substanzen bei Patienten und Patientinnen mit chronischer koronarer Herzerkrankung harte kardiovaskuläre Endpunkte reduzieren, was die Rolle von Inflammation in kardiovaskulären Erkrankungen in den Vordergrund hebt. Interessanterweise wurde in klinischen Studien zu Inkretinmimetika neben der Reduktion des Langzeitblutzuckers, des Körpergewichts und der Verbesserung kardiovaskulärer Endpunkte ebenfalls eine Reduktion des hsCRP beobachtet: Um bis zu 40 % in SELECT und 39 % in SUMMIT konnten Semaglutid und Tirzepatid im Vergleich zu den Ausgangswerten die hsCRP-Spiegel in den jeweiligen Studien reduzieren [20,28]. Insgesamt mehren sich die Hinweise, dass Inkretinmimetika kardiovaskuläre Ereignisse nicht allein über Gewichtsreduktion und bessere Blutzuckerkontrolle beeinflussen, sondern zusätzlich durch direkte antiatherogene und antiinflammatorische Mechanismen wirken [33]. Dafür sprechen u. a. parallele Senkungen von Entzündungsmarkern (z. B. hsCRP) und Verbesserungen kardiovaskulärer Endpunkte, teils unabhängig und vor Eintreten der Glucosekontrolle und Gewichtsreduktion. Klinisch bedeutet dies, dass bei einem CKM-Syndrom Inkretinmimetika über den metabolischen Nutzen hinaus einen zusätzlichen kardiovaskulären Benefit entfalten können.

Inkretinmimetika sind heute keine reinen Antidiabetika mehr, sondern kardiometabolische Wirkstoffe mit pleiotropen protektiven Effekten. Bei bestehendem T2DM und ASCVD sind GLP-1-RA Teil der Erstlinientherapie und zeigen zudem potente Effekte in der Gewichtsreduktion. Auch bei Patientinnen und Patienten mit ASCVD und Adipositas ohne Diabetes reduziert Semaglutid kardiovaskuläre Ereignisse. Bei einer HFpEF zeigen Inkretinmimetika klinisch relevante Vorteile und verbessern sowohl Symptomatik als auch harte Endpunkte. Die zugrunde liegenden Mechanismen gehen über Blutzucker- und Gewichtsreduktion hinaus und beruhen unter anderem auf direkten antiatherogenen und antiinflammatorischen Effekten. Damit stellen Inkretinmimetika einen Paradigmenwechsel im Kontinuum des CKM-Syndroms dar und verdeutlichen, dass das Zusammenspiel von Herz, Niere, Stoffwechsel und Immunsystem organübergreifend gedacht und interdisziplinär behandelt werden muss.
Korrespondierender Autor

Dr. med. Berkan Kurt
Klinik für Kardiologie, Angiologie und Internistische Intensivmedizin (Medizinische Klinik I) Universitätsklinikum Aachen
Bildnachweis: Graficaprint (gettyimages), Anucha (Adobe Stock); privat