
Schätzungen zufolge sind in Deutschland 1,7 Millionen Menschen im Alter über 65 Jahre von Demenz betroffen [1]. Auch wenn eine kurative Therapie noch nicht in Sicht ist, so gibt es vielversprechende Ansätze zur Modifikation der Krankheitsprogression im frühen Stadium. Ein Überblick.
Morbus Alzheimer ist mit 60–80 % die häufigste Ursache für das Demenzsyndrom [2]. Die multifaktorielle Pathologie der Erkrankung umfasst extrazelluläre Amyloid-β-Plaques (Aβ), intrazelluläre neurofibrilläre Tau-Tangles (NFTs), chronische Neuroinflammation und zerebrovaskuläre Dysfunktion, die zum Verlust von Synapsen und zum Absterben von Neuronen führt [3]. Die Hypothese der Amyloidkaskade zeigt, dass die Ablagerung von Aβ eine Abfolge von Ereignissen auslöst, die zur Entwicklung der Tau-Pathologie sowie zur Aktivierung von Mikroglia und zur Freisetzung von Zytokinen wie Interleukin(IL)-1β und Tumornekrosefaktor(TNF)-α führt, was wiederum eine Neurodegeneration bedingt [4]. Die Neuroinflammation, die durch die Aktivierung von Mikroglia und Astrozyten ausgelöst wird, verstärkt die Pathologie, während die zerebrovaskuläre Dysfunktion die Beseitigung toxischer Proteine beeinträchtigt [5].
Heutzutage besteht die Möglichkeit, durch nicht invasive Bildgebungsverfahren oder Biomarker wie Plasma pTau217 [6] Alzheimer frühzeitig zu diagnostizieren. Es wird angenommen, dass in der sehr frühen Krankheitsphase noch wirksam ins Krankheitsgeschehen eingegriffen werden kann [7].
Intensive Forschung
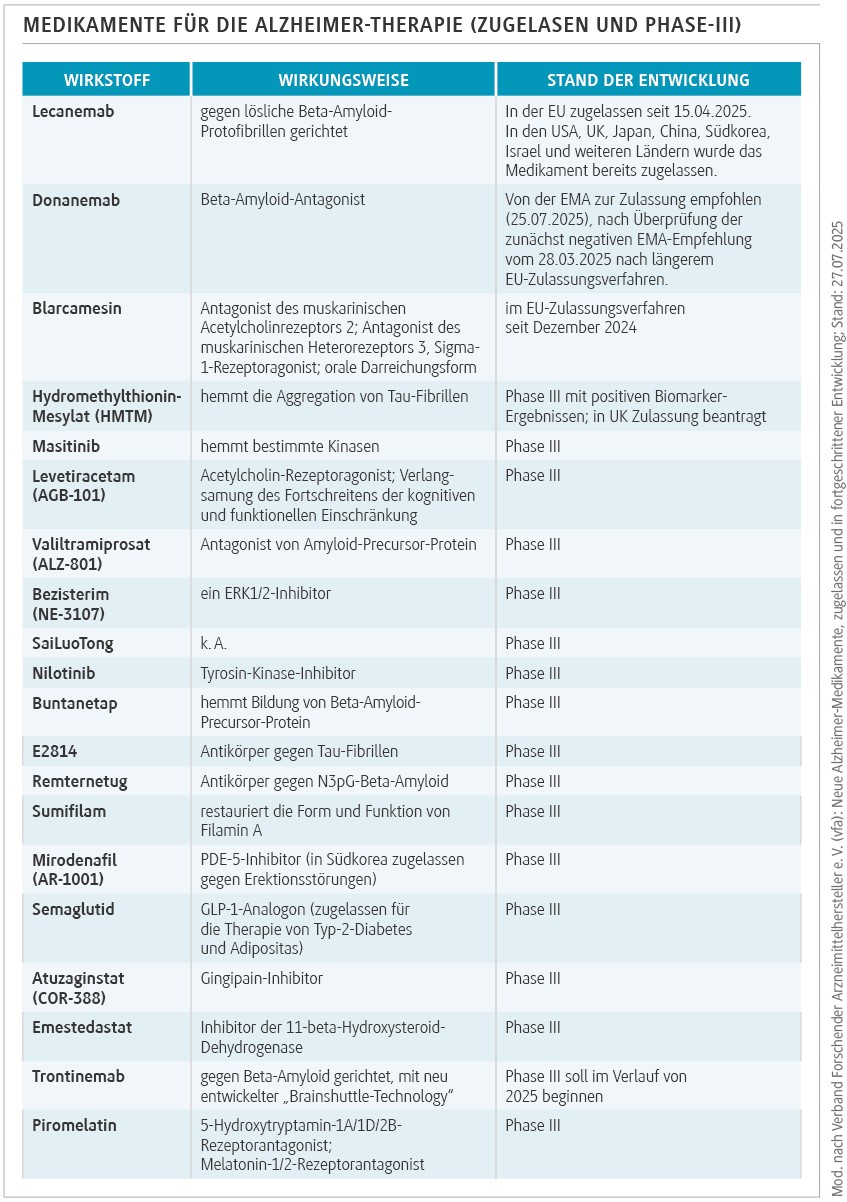
In den vergangenen zwei Jahrzehnten war die Erforschung neuer Alzheimer-Therapien eher von Rückschlägen geprägt: So ergab eine Auswertung, dass die zwischen 2002 und 2012 in klinischen Studien erprobten Medikamente für diese Indikation eine Misserfolgsquote von 99,6 % aufwiesen [8]. Eine kontroverse Diskussion löste im Jahr 2021 der Antikörper Aducanumab aus: Nach widersprüchlichen Ergebnissen in zwei Phase-III-Studien erteilte die FDA dem Medikament eine beschleunigte Zulassung in den USA, mit der Auflage, weitere Studien zur klinischen Wirksamkeit durchzuführen. Die Europäische Arzneimittel-Agentur (EMA) hingegen lehnte die Zulassung in Europa ab und begründete dies mit der nicht nachgewiesenen Wirksamkeit und den zum Teil schweren Nebenwirkungen [9]. Inzwischen wurden die Entwicklung und der Verkauf des Präparates eingestellt. Trotz der Fehlschläge ist die Pipeline der potenziellen Therapieansätze gegen Alzheimer gut gefüllt (Tab.). Neben den zahlreichen Wirkstoffen in der letzten Phase der klinischen Erprobung befinden sich derzeit 60 weitere Medikamente in den Phasen I und II [7].
Erster Antikörper bei Alzheimer zugelassen
Das Jahr 2025 könnte nun ein Wendepunkt sein: Seit April ist mit Lecanemab der erste monoklonale Antikörper gegen Alzheimer in der EU zugelassen [10]. Er kann zur Behandlung erwachsener Patientinnen und Patienten mit klinisch diagnostizierter leichter kognitiver Störung (mild cognitive impairment, MCI) und leichter Demenz aufgrund der Alzheimer-Krankheit mit bestätigter Amyloid-Pathologie (Apolipoprotein-E-ε4[ApoE-ε4]-Nichtträger oder heterozygote ApoE-ε4-Träger) angewendet werden [11]. Bei Betroffenen mit zwei Kopien des ApoE-ε4-Gens ist die Gefahr für Nebenwirkungen, sogenannte Amyloid-related Imaging Abnormalities (ARIA), zu hoch. Lecanemab zielt spezifisch auf Aβ-Protofibrillen. In der zulassungsrelevanten CLARITY-AD-Studie erreichten Patientinnen und Patienten mit Alzheimer im Frühstadium unter Lecanemab eine 27%ige Verringerung der Clinical Dementia Rating Sum of Boxes (CDR-SB) und eine 50%ige Verringerung der Protofibrillen-Zahl im Liquor [12]. Die Amyloid-PET-Ergebnisse zeigten einen Rückgang um 60 Centiloid, und 68 % der Teilnehmenden erzielten innerhalb von 18 Monaten eine Clearance.
Empfehlung für monoklonalen Antikörper
Ende Juli hat der Ausschuss für Humanarzneimittel (CHMP) der EMA eine positive Stellungnahme zum monoklonalen Antikörper Donanemab veröffentlicht. Darin wird das Präparat für die Behandlung von Erwachsenen mit einer leichten kognitiven Störung oder leichten Demenz infolge der Alzheimer-Krankheit, bei denen es sich um heterozygote ApoE-ε4-Träger oder -Nichtträger handelt und bei denen eine Amyloid-Pathologie bestätigt wurde, empfohlen [13]. Es wird erwartet, dass die Europäische Kommission in den kommenden Monaten eine regulatorische Entscheidung zu Donanemab treffen wird. Noch im Frühjahr hatte sich der Ausschuss zunächst gegen die Zulassung ausgesprochen, mit dem Hinweis auf zu große Nebenwirkungen. Auf diese negative Empfehlung reagierten unter anderem Forschende des European Alzheimer’s Disease Consortium (EADC) mit Unverständnis: So sei die Diskrepanz zwischen der positiven Empfehlung für Lecanemab und der negativen Empfehlung gegen Donanemab willkürlich, nicht mit den wissenschaftlichen Erkenntnissen vereinbar und nicht zum Nutzen von Betroffenen und Pflegenden [14].
Donanemab erkennt Pyroglutamat-modifiziertes Aβ in Plaques. In der Phase-III-Studie TRAILBLAZER-ALZ 2 konnte bei Patientinnen und Patienten mit früher Alzheimer-Krankheit mit niedrigen/mittleren Tau-Werten über einen Zeitraum von 18 Monaten eine Verringerung der integrierten Alzheimer-Krankheits-Ratingskala (iADRS) um 35 % erreicht werden, wobei die Plaque-Clearance bei einer Dosierung von 10 mg/ kg Donanemab alle vier Wochen 80 % betrug [15].
Weitere monoklonale Antikörper befinden sich derzeit in unterschiedlichen Phasen der Entwicklung. Im Dezember 2024 wurde bei der EMA die Zulassung des small molecules Blarcamesin beantragt [16], nachdem der Wirkstoff in einer Phase-III-Studie die klinische Verschlechterung bei Betroffenen im Frühstadium der Alzheimer-Krankheit deutlich verlangsamen konnte und ein günstiges Sicherheitsprofil ohne unerwünschte Nebenwirkungen bei der Neurobildgebung zeigte [17].
Bispezifische Antikörper gegen Alzheimer
Ein in der Onkologie erprobtes Konzept sind bispezifische Antikörper: Diese binden zwei Antigene und könnten sich bei Morbus Alzheimer gegen die multifaktorielle Pathologie, einschließlich Aβ, Tau und Neuroinflammation richten [18]. So resultierte beispielsweise die Kombination von Anti-Aβ/Anti-Tau-Antikörpern im Mausmodell in einem Rückgang der aggregierten Pathologie [19]. Die doppelte Spezifität dieser Antikörper verhindert, dass Aβ die Tau-Phosphorylierung aktiviert, was zu stabilisierten Mikrotubuli und einer Verbesserung der synaptischen Dichte im Hippocampus führt [19]. Ein weiterer Vorteil der bispezifischen Antikörper bei der Alzheimer-Therapie könnte in der verbesserten Überwindung der Blut-Hirn-Schranke liegen [20]. Aktuell werden bispezifische Antikörper bei Alzheimer in frühen klinischen Studien (Phase I/II) getestet.
sCLU als therapeutisches Target
Das zytoprotektive Protein secreted Clusterin (sCLU) verhindert die Aggregation von Aβ und Tau, moduliert Inflammationsvorgänge und unterstützt die synaptische Funktion. Eine reduzierte sCLU-Expression ist mit einem erhöhten Alzheimer-Risiko assoziiert. Mit dem präklinischen Wirkstoffkandidat DDL-357 ist es einem Forschungsteam aus den USA nun gelungen, ein oral verfügbares, hirngängiges Präparat zu entwickeln, das gezielt die sCLU-Bildung anregt [21]. Als Enhancer für sCLU wurden BET-Inhibitoren identifiziert. Der dadurch optimierte Wirkstoff DDL-357 zeigte nach zweiwöchiger oraler Gabe im Mausmodell eine Erhöhung der sCLU-Spiegel im Gehirn. Bei einer sechswöchigen Gabe konnten die phosphorylierten Tau-Proteine reduziert und die Gedächtnisleistung im Barnes-Maze-Test verbessert werden. Auf Basis dieser Daten sind nun erweiterte Tierstudien mit größeren Kohorten, längeren Behandlungszeiten und geschlechtsspezifischer Auswertung geplant. Der Therapieansatz von DDL-357 könnte laut den Forschenden auch für Erkrankungen wie ALS oder Morbus Parkinson geeignet sein.
Mit GLP-1-Analoga gegen Alzheimer
Der Glucagon-like Peptide-1-Rezeptoragonist (GLP-1-RA) Semaglutid wirkt vorteilhaft auf die Verringerung von Fettleibigkeit, Typ-2-Diabetes (T2D), Bluthochdruck und Herz-Kreislauf-Erkrankungen. Forschungsergebnisse deuten darauf hin, dass Semaglutid entzündungshemmende und immunologische Eigenschaften besitzt und die Gefäßfunktion verbessern kann. Somit könnte gleichzeitig auf mehrere Risikofaktoren und proximale Mechanismen der Demenz eingewirkt werden [22]. Eine Studie verglich daher die Auswirkungen von Semaglutid im Vergleich zu anderen Antidiabetika auf die Erstdiagnose von Morbus Alzheimer: Während eines 3-Jahres-Follow-ups war Semaglutid mit einem signifikant geringeren Risiko für das Auftreten von Alzheimer im Vergleich zu anderen Antidiabetika bei Erkrankten mit T2D während eines 3-Jahres-Follow-ups verbunden [22]. Aktuell befindet sich Semaglutid in der Phase III der klinischen Erprobung bei Alzheimer (Tab.).
Ansätze aus der integrativen Medizin
Auch die Komplementärmedizin erforscht mögliche Ansätze zu Prävention bzw. Verlaufsmodifikation. Eine Arbeitsgruppe am Universitätsklinikum Tübingen plant eine Studie mit 100 MCI-Patienten und -Patientinnen, die die Wirkung von Yoga, High Intensity Interval Training (HIIT) und Intermittierender Hypoxie/Hyperoxie Exposition (IHHE) über 12 Wochen auf die kognitive Funktion evaluiert [23]. Gemeinsames Wirkprinzip der drei Interventionen ist eine nachhaltige Verbesserung der Hirndurchblutung und der Mitochondrienfunktion durch Veränderungen des zerebralen Sauerstoffangebots.
Die Progression der Demenz wird neben biologischen Faktoren auch durch soziale Aspekte beeinflusst. So erfolgen Heimeinweisungen zu einem großen Teil nicht aufgrund objektiver Pflegebedürftigkeit der Betroffenen, sondern wegen Überlastung der Angehörigen. Ein dritter komplementärer Ansatz befasst sich daher mit der sogenannten Caregiver Burden – der wahrgenommenen Belastung der pflegenden Angehörigen: Forschende der Universitätsmedizin Essen entwickeln aktuell ein Mind-Body-Programm zur Förderung der Gesundheitskompetenz und mentalen Gesundheit von Pflegepersonen. Ziel ist es, die Resilienz der Angehörigen zu stärken und ihre Caregiver Burden zu reduzieren. Dadurch soll eine Zuwendung ermöglicht werden, die über alltägliche Pflegeroutinen hinausgeht. Auch dieses Projekt ist auf 3 Jahre ausgelegt [23].

Vor allem durch Antikörpertherapien gegen Aβ konnten in den vergangenen Jahren deutliche Fortschritte erzielt werden. Wichtige Faktoren sind dabei die frühzeitige Diagnose und Therapieeinleitung. Die Pipeline ist gut gefüllt, aber es muss noch gezeigt werden, inwieweit eine Progression zukünftig dadurch aufgehalten werden kann.
