
Immer mehr zuvor off-label aus der Erwachsenenmedizin entlehnte Rheumamittel sind inzwischen auch für Kinder und Jugendliche zugelassen. Biologika und Januskinase-Inhibitoren erlauben es, frühzeitig wirksam in den Krankheitsverlauf einzugreifen und Langzeitschäden zu verhindern.
Gerade bei Kindern und Jugendlichen mit Rheuma ist therapeutisch keine Zeit zu verlieren. Bei unzureichender Krankheitskontrolle drohen ihnen über die Lebenszeit erhebliche Behinderungen, neben Gelenkschäden auch Wachstumsstörungen, wie Extremitäten-Asymmetrien oder eine Mikrognathie bei Kiefergelenksbefall. Daher ist das Therapieziel Remission von vornherein noch strikter zu verfolgen als bei Erwachsenen, zumal es auch bei juveniler idiopathischer Arthritis (JIA) Hinweise auf ein „Window of Opportunity“ gibt. Biologische (b) und targeted systemic (ts) Disease Modifying Antirheumatic Drugs (DMARDs) gewinnen daher zunehmend an Bedeutung.
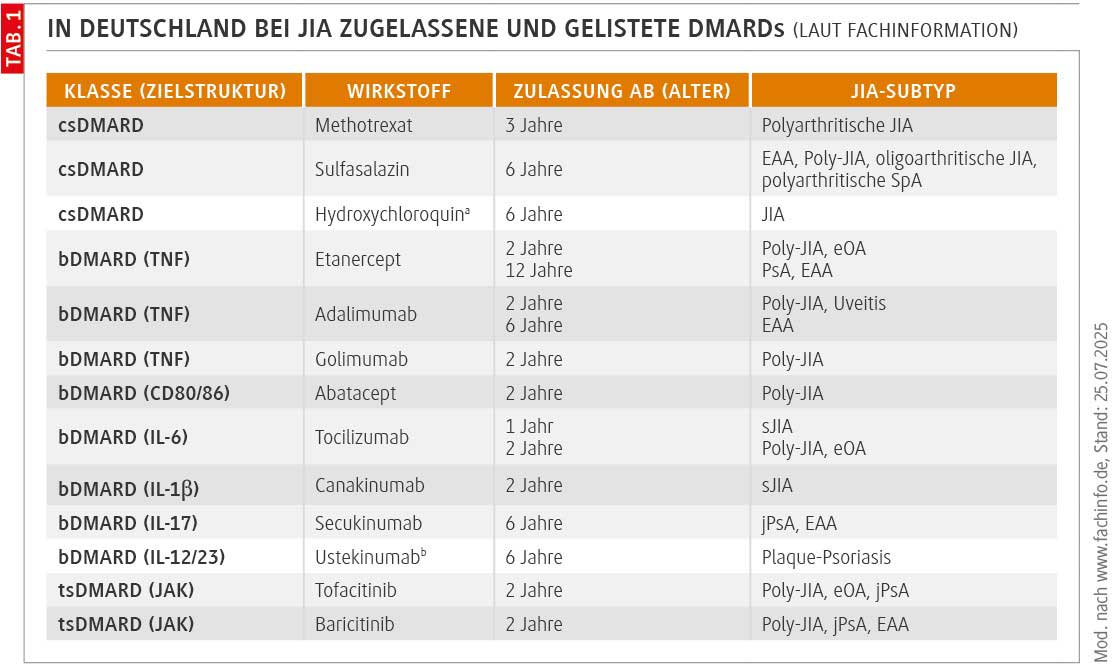
US-Versicherungsdaten aus 2000–2022 zu 20 258 DMARD-Therapieeinleitungen bei 13 696 JIA-Patienten und -Patientinnen [1] belegen deutlich rückläufige Trends bei Neuverordnungen konventionell synthetischer (cs) DMARDs von 89,5 % auf 43,2 %, während Biologika 2022 schon die Hälfte aller Neuverordnungen ausmachten. Spitzenreiter unter den b/tsDMARD-Neuverordnungen war 2022 der in den USA 2008 bei JIA zugelassene Tumornekrosefaktor-α-Inhibitor (TNFi) Adalimumab mit 20,5 %. Der Antikörper profitierte auch von einer Formulierung, deren Injektion weniger schmerzt. Ansonsten legten vor allem der Interleukin(IL)-12/23-Inhibitor Ustekinumab, das gegen IL-17 gerichtete Secukinumab und der Januskinase-Inhibitor (JAKi) Tofacitinib zu. Dass Ustekinumab das am zweithäufigsten verordnete bDMARD war, lag wohl daran, dass ein Viertel der Teilnehmenden eine Psoriasis hatte. Dafür war es zuerst zugelassen. Für die psoriatische JIA folgte die US-Zulassung ab 6 Jahren im August 2022, in Deutschland steht sie noch aus (Tab. 1).
Mit Zulassung weiterer b/tsDMARDs ist zu rechnen. So gibt es beispielsweise erste positive Daten zu Upadacitinib aus einer offenen Phase-I-Studie [2]. Bei systemischer JIA (sJIA) war ein neuer Anti-IL-1β-Antikörper, Firsekibart (früher Genakumab) in einer offenen Phase-II-Studie an Tag 28 ähnlich wirksam wie Tocilizumab [3].
Treat-to-Target (T2T) spart Zeit
Dass T2T-Ansätze mit früher Kombinationstherapie auch in der Kinder- und Jugendrheumatologie machbar sind und Krankheitsaktivität, Funktion und Lebensqualität bedeutsam verbessern können, belegt etwa eine prospektive Beobachtungsstudie aus Deutschland [4]: 129 Patienten und Patientinnen mit polyartikulärer JIA erhielten eine Behandlung nach den am JADAS 10 (10-Gelenke Juvenile Arthritis Disease Activity Score) orientierten T2T-Vorgaben der Initiative „Protokolle in der Kinderrheumatologie“ (PROKIND):
Es gab 3 Ausgangskohorten: alleinige Methotrexat(MTX)-Therapie (Kohorte 1), zusätzlich intravenöse Glukokortikoid(GC)-Pulstherapien (Kohorte 2), begleitende intraartikuläre GC-Injektionen in mindestens 5 Gelenke (Kohorte 3). Wurden die Therapieziele nicht erreicht, wurde die Therapie eskaliert. In Kohorte 1 wurde dann bereits zu Monat 3 ein bDMARD eingeführt, weiter mit MTX oder allein. Insgesamt hatten nach einem Jahr 66,7 % eine JADAS-Remission. In Kohorte 1 waren es 72,4 %, in Kohorte 2 50 %, in Kohorte 3 69,2 %. Weder durch wiederholte GC-Pulse noch durch intraartikuläre GC-Gaben ließ sich die Eskalation auf Biologika vermeiden.
Glukokortikoide nur bei schwerer sJIA
Während intraartikuläre GC bei oligoartikulärer JIA als häufigstem Subtyp größtenteils als Erstlinientherapie dienen, sind systemische GC wegen Negativeffekte auf das Wachstum bei Kindern noch strikter zu meiden, als generell geboten. Bei schwerer sJIA und besonders beim Makrophagen-Aktivierungs-Syndrom (MAS), ihrer gefürchtetsten, lebensbedrohlichen Komplikation, sind sie aber wegen ihres raschen Wirkeintritts erste Wahl.
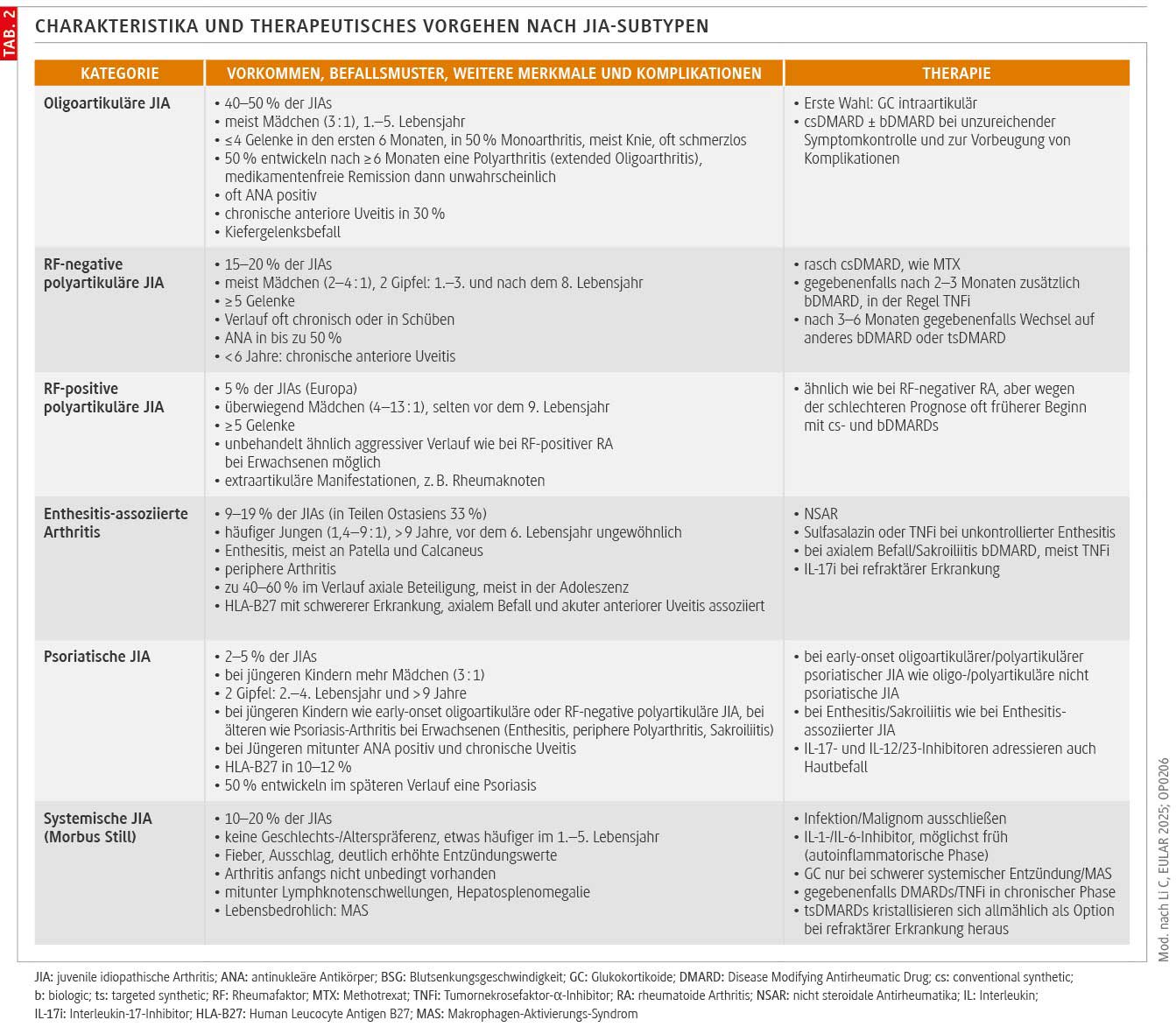
Generell richtet sich die Therapie nach dem JIA-Subtyp [5] (Tab. 2). Bis dato gilt die Klassifikation der International League Against Rheumatism (ILAR), die Paediatric Rheumatology International Trials Organisation (PRINTO) unterscheidet in einem neueren, noch nicht abschließend validierten Vorschlag nur noch sJIA, Rheumafaktor(RF)-positive JIA, Enthesitis/Spondylitis-assoziierte JIA, early-onset ANA(antinukleäre Antikörper)-positive JIA und andere. Damit soll die Therapie besser an Pathogenese und Prävention von Langzeitfolgen ausgerichtet werden [6].
Oligoartikuläre JIA, polyartikuläre JIA und die rheumatoide Arthritis Erwachsener stellen womöglich ein Kontinuum dar. Auch kindliches (sJIA) und adultes Still-Syndrom werden inzwischen als Ausprägungen derselben Erkrankung angesehen. Trotz Parallelen lassen sich die JIA-Subtypen aber nicht ohne Weiteres mit den Krankheitsbildern Erwachsener gleichsetzen. So kommt es bei sJIA häufiger zu schweren Komplikationen: Neben einem MAS bei mindestens 10 % werden vor allem bei jüngeren Kindern mit höherer systemischer Entzündungsaktivität zunehmend schwere Lungenbeteiligungen beobachtet. Auffällig ist ein zeitlicher Zusammenhang mit steigendem Gebrauch von IL-1- und IL-6-Inhibitoren, die Pathogenese ist aber unklar [5].
Auf Augen und Kiefergelenke achten!
Weitere Besonderheiten kindlichen Rheumas, die Wachsamkeit erfordern und durch eine frühe wirksame Behandlung ebenso verhindert werden sollen, wie etwa die Ausweitung einer Oligoarthritis auf 5 oder mehr Gelenke, sind akute und chronische anteriore Uveitiden und Kiefergelenksbefall. Für beides gibt es eigene Therapieleitlinien auf Sk2- bzw. S3-Niveau [7,8]. Die allgemeine JIA-Therapieleitlinie [9] von 2019 ist 2024 abgelaufen und wird derzeit überarbeitet.
Chronische Uveitiden, die meist bei oligoartikulärer, RF-negativer polyartikulärer und psoriatischer JIA vorkommen, können zur Erblindung führen. Weil sie sich zu 90 % in den ersten 4 Krankheitsjahren – selten auch vor JIA-Diagnose – manifestieren, benötigen Kinder und Jugendliche mit JIA anfangs besonders engmaschig ophthalmologische Früherkennungsuntersuchungen: alle 3–6 Monate. Über 40 % kommen mit GC-Augentropfen nicht aus und brauchen MTX, einen TNFi oder beides. Reicht auch das nicht, kommen Tocilizumab, Abatacept, JAKi oder Rituximab infrage. Explizit bei JIA-Uveitis zugelassen ist in Deutschland allerdings nur Adalimumab.
Bei Kiefergelenksentzündungen werden bei Versagen aller konservativen Maßnahmen – Medikamente, Schienen, Kieferorthopädie – mitunter kieferchirurgische Korrekturen nötig. Intraartikuläre GC-Injektionen sind nur nach Versagen systemischer Therapien und höchstens einmalig bei isoliertem Kiefergelenksbefall in Betracht zu ziehen.

Die Zulassung von immer mehr b/tsDMARDs für die JIA erlaubt nun auch bei jungen Rheumapatienten und -patientinnen frühzeitige, an den JIA-Subtyp angepasste, effektive Kombinationstherapien nach dem T2T-Prinzip, die schwere Komplikationen, dauernde Schmerzen und Behinderungen vermeiden können.
